网址:http://m.1010jiajiao.com/timu3_id_256104[举报]
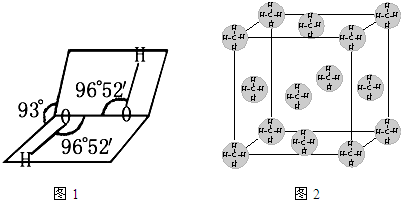
(1)H、O、S电负性由大到小的顺序是
(2)如图1是H2O2的空间构型,H2O2中每个氧都是
(3)H2S和H2O2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(4)甲烷晶体的晶胞如图2所示,此晶体在常温、常压下不能存在的原因
A:
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为
(2)写出基态Cu+的核外电子排布式
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为
(4)写出与CO互为等电子体的离子
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子轨道的杂化类型分别为
(6)铜金合金形成的晶胞如图1所示,其中Cu、Au原子个数比为
B:
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到.
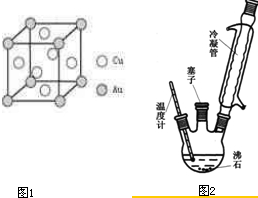
实验室可利用如图2实验装置合成对氨基苯磺酸.实验步骤如下:
1在一个250mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入18mL浓硫酸.
2将三颈烧瓶置于油浴中缓慢加热至170~180℃,维持此温度2~2.5h.
③将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品.
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干.(说明:100mL水在20℃时可溶解对氨基苯磺酸1.08g,在100℃时可溶解6.67g.)
试回答填空.
(1)装置中冷凝管的作用是
(2)步骤②中采用油浴加热,下列说法正确的是
A.用油浴加热的好处是反应物受热均匀,便于控制温度
B.此处也可以改用水浴加热
C.实验装置中的温度计可以改变位置,也可使其水银球浸入在油中
(3)步骤③用少量冷水洗涤晶体的好处是
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先
(5)步骤④中有时需要将“粗产品用沸水溶解,冷却结晶,抽滤”的操作进行多次,其目的是
T、X、Y、Z、R、W为周期表前四周期元素,原子序数依次递增.已知:
①W原子最外层有1个电子,属于ds区元素,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是________(用元素符号表示).
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是________.
(3)W的基态原子的价层电子排布式为________,该元素与元素Y、T能形成的[W(YT3)4]2+离子中,含有的化学键是________.
a.离子键
b.极性键
c.非极性键
d.配位键
画出其结构式________
(4)T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,则该分子中中心原子采取________杂化,1 mol M分子中σ键和π键的个数比为________.
(5)T和Z可以形成个数比为1∶1的分子,其中中心原子采取________杂化;通常情况下,该分子与水任意比互溶的主要原因是________.
T、X、Y、Z、R、W为周期表前四周期元素,原子序数依次递增。已知:
①W原子最外层有1个电子,属于ds区元素,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是 __________ ___(用元素符号表示)。
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是 。
(3)W的基态原子的价层电子排布式为 ,该元素与元素Y 、T能形成的[W(YT3)4]2+离子中,含有的化学键是 。
a.离子键 b.极性键 c.非极性键 d.配位键
画出其结构式_____________
(4) T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,则该分子中中心原子采取_____ 杂化,1molM分子中σ键和π键的个数比为 。
(5) T和Z可以形成个数比为1:1的分子,其中中心原子采取 杂化;通常情况下,该分子与水任意比互溶的主要原因是 。
查看习题详情和答案>>
T、X、Y、Z、R、W为周期表前四周期元素,原子序数依次递增。已知:
①W原子最外层有1个电子,属于ds区元素,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是 __________ ___(用元素符号表示)。
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是 。
(3)W的基态原子的价层电子排布式为 ,该元素与元素Y 、T能形成的[W(YT3)4]2+离子中,含有的化学键是 。
a.离子键 b.极性键 c.非极性键 d.配位键
画出其结构式_____________
(4) T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,则该分子中中心原子采取_____ 杂化,1molM分子中σ键和π键的个数比为 。
(5) T和Z可以形成个数比为1:1的分子,其中中心原子采取 杂化;通常情况下,该分子与水任意比互溶的主要原因是 。