网址:http://m.1010jiajiao.com/timu3_id_255644[举报]
 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用.(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1反应Ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2①在以上制备甲醇的两个反应中:反应I优于反应II,原因为
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数的数值:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
II、某温度下,将1mol CO和4molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-Q1kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-Q2 kJ/mol③H2O(g)=H2O(l)△H3=-Q3 kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:
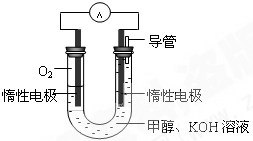
(3)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置,工作一段时间后,测得溶液的pH将
 完全燃烧0.1mol某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重9.0g,乙装置增重17.6g.
完全燃烧0.1mol某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重9.0g,乙装置增重17.6g.求(1)该烃的化学式;
(2)写出其所有的结构简式?(写出具体计算步骤)
(13分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
|
实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v (CO2) 表示的反应速率为 (保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 (填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:
。
⑷某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
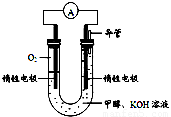
①该电池负极的电极反应为: 。
②该电池工作时,溶液中的OH-向______极移动。
查看习题详情和答案>>