网址:http://m.1010jiajiao.com/timu3_id_255369[举报]
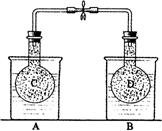
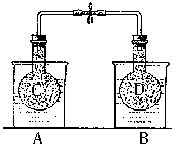 NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把烧瓶C放人A烧杯中,烧瓶D放人B烧杯中。
NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把烧瓶C放人A烧杯中,烧瓶D放人B烧杯中。往A烧杯中加入50.0gNH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0gNaOH固体搅拌使其溶解。回答下列问题:
(1)烧杯A中温度(填“升高”、“降低”或“不变”)_______;烧杯B中温度(填“升高”、“降低”或“不变”)_______。
(2)已知在NO2生成N2O4的可逆反应里,正反应是放热反应,逆反应是吸热反应:
2NO2(g)
 N2O4(g)
N2O4(g)从上面实验可知烧瓶C内混合气体的颜色(填“变浅”、“变深”或“不变”)______;D烧瓶内混合气体的颜色(填“变浅”、“变深”或“不变”)________。
(3)用pH试纸测定烧杯A中溶液的pH可知其pH(填“大于7”、“等于7”或“小于7”)_________,导致该溶液pH这一变化的原因可用离子方程式表示如下:____________。
(4)若实验测得B烧杯中酸碱中和反应放热1.4325kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为________________________________。
(5)若起始时在D烧瓶中充人mgN2O4,此时测得烧瓶中的压强为1.01×105Pa,当可逆反应:N2O4(g)
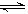 2NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为___________(精确到小数点后两位)。
查看习题详情和答案>>
2NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为___________(精确到小数点后两位)。
查看习题详情和答案>>
| |||||||||||||||||||||||
A.等于5 s B.等于10 s
C.大于10 s D.小于10 s
查看习题详情和答案>>将9.2 g N2O4晶体放入容积为2 L的密闭容器中,升温到25℃时N2O4全部气化,由于N2O4发生如下分解反应:
N2O4(g)平衡后,在25℃时测得混合气体(N2O4和NO2)的压强为同温下N2O4(g)尚未分解时压强的1.2倍.试回答:
(1)平衡时容器内NO2和N2O4的物质的量之比为________.
(2)平衡时该反应的化学平衡常数K为________.
(3)如果改变该可逆反应的下列条件,则平衡常数是否改变?
①加压:________;
②升高温度:________;
③增大N2O4的浓度:________.
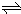
2NO2 (g),如图所示.
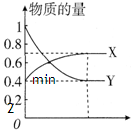
(1)曲线______ (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若升高温度,则v(正)______,v(逆)______(填“加快”或“减慢”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲
中v(NO2)=0.3mol?L-1?min-1,乙中v (N2O4)=0.2mol?L-1?min-1,则______中反应更快.
(4)在0到1min中内用X表示该反应的速率是______,该反应达最大限度时,Y的转化率______,反应开始时与反应达平衡状态时的压强之比为______.
(5)下列描述能表示反应达平衡状态的是______.
A.容器中X与Y的物质的量相等B.容器内气体的颜色不再改变
C.容器的压强保持一定D.容器内气体的平均相对分子质量不再改变
E.2v(X)=v(Y)
(6)若1mol N2O4完全转化为2mol NO2 (g)时吸收QKJ的热量,在一密闭容器中充入2mol NO2 (g),容器内温度______(升高、降低或不变).达到反应限度时反应产生的热量______QKJ(大于、小于或等于).