网址:http://m.1010jiajiao.com/timu3_id_255146[举报]
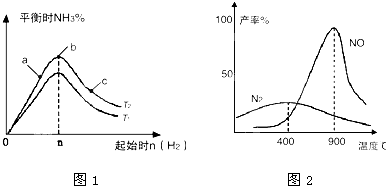
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
②若容器容积为1L,n=3mol,反应达到平衡时N2、H2的转化率均为60%,则在起始时体系中加入N2的物质的量为
③图象中T2和T1的关系是
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图2):
4NH3+5O2?4NO+6H2O,4NH3+3O2?2N2+6H2O
温度较低时以生成
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为____ _____。
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递![]() )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2
)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H22NH3,则在电化学合成氨的过程中,阴极反应式为___ ______。
(3)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g)
△H<0,其化学平衡常数K与t的关系如下表:
| t / K | 298 | 398 | 498 | …… |
| K / (mol·L-1)-2 | 4.1×106 | K1 | K2 | …… |
请完成下列问题:
①写出Km的表达式 ,判断K1的相对大小,K1_______4.1×106 (填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.v(N2)(正) = 3v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
E. 浓度积Q=K时
(4)①NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是 。
②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为( )
A.C(Cl-)>C(NH4+)>C(H+)>C(OH-)
B.C(NH4+)>C(Cl-)>C(OH-)>C(H+)
C.C(Cl-)>C(NH4+)>C(OH-)>C(H+)
D.C(NH4+)>C(Cl-)>C(H+)>C(OH-)
查看习题详情和答案>>
氮是地球上含量丰富的一种元素,氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物,在工农业生产、生活中有着重大作用。
(1)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。
①在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
则该反应的平衡常数的表达式为________;判断K1________K2(填“>”、“<”或“=”)。
②下列各项能说明该反应已达到平衡状态的是________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③一定温度下,在1 L密闭容器中充入1 mol N2和3 mol H2并发生上述反应。若容器容积恒定,10 min达到平衡时,气体的总物质的量为原来的
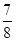 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。(2)肼可用于火箭燃料、制药原料等。
①在火箭推进器中装有肼(N2H4)和液态H2O2,已知0.4 mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6 kJ的热量。该反应的热化学方程式为________________________________________________________________________。
②一种肼燃料电池的工作原理如图所示。该电池工作时负极的电极反应式为_____________________________________。

③加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式_______________________________________。
肼与亚硝酸(HNO2)反应可生成叠氮酸,8.6 g叠氮酸完全分解 可放出6.72 L氮气(标准状况下),则叠氮酸的分子式为________。 查看习题详情和答案>>
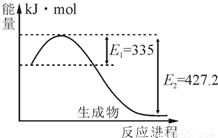
(1)如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为 .
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递HH+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2
 2NH3,则在电化学合成氨的过程中,阴极反应式为 .
2NH3,则在电化学合成氨的过程中,阴极反应式为 .(3)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)
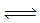 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:、C(H2)、C(NH3)分别为平衡浓度)
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:、C(H2)、C(NH3)分别为平衡浓度)| t/K | 298 | 398 | 498 | … |
| K/-2 | 4.1×106 | K1 | K2 | … |
①试确定K1的相对大小,K1 4.1×106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母).
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性,这是由于NH4+水解的缘故.则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是 .
②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为
A.C(Cl-)>C(NH4+)>C(H+)>C(OH-)
B.C(NH4+)>C(Cl-)>C(OH-)>C(H+)
C.C(Cl-)>C(NH4+)>C(OH-)>C(H+)
D.C(NH4+)>C(Cl-)>C(H+)>C(OH-) 查看习题详情和答案>>
(1)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。
①在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
则该反应的平衡常数的表达式为________;判断K1________K2(填“>”、“<”或“=”)。
②下列各项能说明该反应已达到平衡状态的是________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③一定温度下,在1 L密闭容器中充入1 mol N2和3 mol H2并发生上述反应。若容器容积恒定,10 min达到平衡时,气体的总物质的量为原来的
 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。(2)肼可用于火箭燃料、制药原料等。
①在火箭推进器中装有肼(N2H4)和液态H2O2,已知0.4 mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6 kJ的热量。该反应的热化学方程式为________________________________________________________________________。
②一种肼燃料电池的工作原理如图所示。该电池工作时负极的电极反应式为_____________________________________。

③加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式_______________________________________。
肼与亚硝酸(HNO2)反应可生成叠氮酸,8.6 g叠氮酸完全分解 可放出6.72 L氮气(标准状况下),则叠氮酸的分子式为________。