摘要:在273K时把11.5gN2O4气体通入体积为500mL的真空密闭容器中.立即出现了红综色.反应进行到2秒时.NO2含量为0.01mol.进行到60秒时达到平衡.此时容器内混合气的密度是氢气密度的28.75倍.则: (1)开始2秒内有N2O4表示的反应速度为多少? (2)达平衡时.体系的压强是开始时的多少倍? (3)平衡时N2O4的物质的量? (4)平衡后.若压缩容器体积.则再达平衡后.NO2浓度将如何变化?
网址:http://m.1010jiajiao.com/timu3_id_254792[举报]
在373K时,把11.5g N2O4气体通入体积为500mL的真空容器中发生反应:N2O4 2NO2,并立即出现红棕色,反应进行到2s时,NO2含量为0.01mol,进行到60s时,达到平衡,此时容器内混合气体的密度是氢气密度的28.75倍,则
2NO2,并立即出现红棕色,反应进行到2s时,NO2含量为0.01mol,进行到60s时,达到平衡,此时容器内混合气体的密度是氢气密度的28.75倍,则
(1)开始2s内以N2O4的浓度变化表示的反应速率为多少?
(2)达到平衡时体系内压强是开始时的多少倍?
查看习题详情和答案>>在373K时,把11.5g![]() 气体通入体积为500mL的真空密闭容器中,立即出现红棕色;反应进行到2s时,
气体通入体积为500mL的真空密闭容器中,立即出现红棕色;反应进行到2s时,![]() 含量为0.01mol;进行到60s时,达到平衡此时容器内混合气体的密度是
含量为0.01mol;进行到60s时,达到平衡此时容器内混合气体的密度是![]() 密度的28.75倍.则下列叙述中正确的是
密度的28.75倍.则下列叙述中正确的是
[
]A.开始时以![]() 表示的反应速率为0.01mol/(L·s)
表示的反应速率为0.01mol/(L·s)
B
.达到平衡时,体系内压强是开始时的1.6倍C
.平衡时,D
.平衡后,若压缩容器减小体积,则再达平衡后,NO2的浓度下降 查看习题详情和答案>>某校研究性学习小组同学在实验时把SO2通入装有BaCl2溶液的试管中,出现了白色浑浊物.
(1)实验小组的同学查阅了工具书上的相关数据,经过计算推导得出:即使把SO2通入BaCl2溶液中至饱和,也不可能生成BaSO3,故白色浑浊物只能是BaSO4.你认为所查阅的数据为:SO2饱和溶液中各离子的浓度、SO2的溶解度以及
(2)小组同学对白色浑浊物成分及产生原因进行了各种合理的假设,并分别设计实验验证假设如下:
请把上表填充完全.
(3)写出在验证假设2的实验时,溶液中发生的反应的化学方程式:
(4)请你再提供一种假设.白色浑浊物是BaSO4,造成原因是
查看习题详情和答案>>
(1)实验小组的同学查阅了工具书上的相关数据,经过计算推导得出:即使把SO2通入BaCl2溶液中至饱和,也不可能生成BaSO3,故白色浑浊物只能是BaSO4.你认为所查阅的数据为:SO2饱和溶液中各离子的浓度、SO2的溶解度以及
BaSO3的溶度积或BaSO3的溶解度或Ksp(BaSO3)
BaSO3的溶度积或BaSO3的溶解度或Ksp(BaSO3)
.(2)小组同学对白色浑浊物成分及产生原因进行了各种合理的假设,并分别设计实验验证假设如下:
| 假设 | 实验验证方法及现象 | |
| 假设1 | 白色浑浊物是BaSO3. | 在白色浑浊物中加入过量盐酸,变澄清 在白色浑浊物中加入过量盐酸,变澄清 . |
| 假设2 | 白色浑浊物是BaSO4,造成原因是 BaCl2溶液中溶解的氧气把亚硫酸氧化成硫酸 BaCl2溶液中溶解的氧气把亚硫酸氧化成硫酸 . |
把BaCl2溶液煮沸,冷却后滴加苯液封,再通入SO2.出现轻微浑浊. |
| 假设3 | 白色浑浊物是BaSO4,造成原因是 SO2中混有空气,把亚硫酸氧化成硫酸 SO2中混有空气,把亚硫酸氧化成硫酸 . |
反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中.不出现浑浊. |
(3)写出在验证假设2的实验时,溶液中发生的反应的化学方程式:
2SO2+O2+2H2O=2H2SO4或SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4
2SO2+O2+2H2O=2H2SO4或SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4
、H2SO4+BaCl2=BaSO4↓+2HCl
H2SO4+BaCl2=BaSO4↓+2HCl
;(4)请你再提供一种假设.白色浑浊物是BaSO4,造成原因是
BaCl2溶液中含有Ba(NO)3、HNO3、H2O2、Fe3+等均可
BaCl2溶液中含有Ba(NO)3、HNO3、H2O2、Fe3+等均可
.某校研究性学习小组同学在实验时把一定量的SO2通入装有一定浓度BaCl2溶液的试管中,出现了白色浑浊物。
⑴实验小组的同学查阅了工具书上的相关数据,经过计算推导得出:即使把SO2通入BaCl2溶液中至饱和,也不可能生成BaSO3,故白色浑浊物只能是BaSO4。你认为所查阅的数据为:
SO2的溶解度、SO2饱和溶液中各离子的浓度以及_______________。
⑵小组同学对白色浑浊物成分及产生原因进行了各种合理的假设,并分别设计实验验证假设如下:
⑴实验小组的同学查阅了工具书上的相关数据,经过计算推导得出:即使把SO2通入BaCl2溶液中至饱和,也不可能生成BaSO3,故白色浑浊物只能是BaSO4。你认为所查阅的数据为:
SO2的溶解度、SO2饱和溶液中各离子的浓度以及_______________。
⑵小组同学对白色浑浊物成分及产生原因进行了各种合理的假设,并分别设计实验验证假设如下:
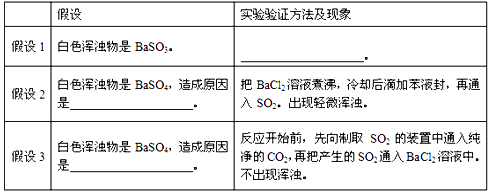
请把上表填充完全。
⑶写出在验证假设2的实验时,溶液中发生的反应的化学方程式:________________、
_______________;
⑷请你再提供一种假设。白色浑浊物是BaSO4,造成原因是________________。
查看习题详情和答案>>
⑶写出在验证假设2的实验时,溶液中发生的反应的化学方程式:________________、
_______________;
⑷请你再提供一种假设。白色浑浊物是BaSO4,造成原因是________________。
某校研究性学习小组同学在实验时把一定量的SO2通入装有一定浓度BaCl2溶液的试管中,出现了白色浑浊物。
⑴实验小组的同学查阅了工具书上的相关数据,经过计算推导得出:即使把SO2通入BaCl2溶液中至饱和,也不可能生成BaSO3,故白色浑浊物只能是BaSO4。你认为所查阅的数据为:
SO2的溶解度、SO2饱和溶液中各离子的浓度以及_______________。
⑵小组同学对白色浑浊物成分及产生原因进行了各种合理的假设,并分别设计实验验证假设如下:
⑴实验小组的同学查阅了工具书上的相关数据,经过计算推导得出:即使把SO2通入BaCl2溶液中至饱和,也不可能生成BaSO3,故白色浑浊物只能是BaSO4。你认为所查阅的数据为:
SO2的溶解度、SO2饱和溶液中各离子的浓度以及_______________。
⑵小组同学对白色浑浊物成分及产生原因进行了各种合理的假设,并分别设计实验验证假设如下:

请把上表填充完全。
⑶写出在验证假设2的实验时,溶液中发生的反应的化学方程式:________________、
_______________;
⑷请你再提供一种假设。白色浑浊物是BaSO4,造成原因是________________。
查看习题详情和答案>>
⑶写出在验证假设2的实验时,溶液中发生的反应的化学方程式:________________、
_______________;
⑷请你再提供一种假设。白色浑浊物是BaSO4,造成原因是________________。