摘要:40%,﹥,2.6a
网址:http://m.1010jiajiao.com/timu3_id_254680[举报]
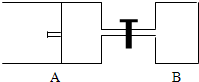 如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y,起始时VA=VB=aL.在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y?2Z+W;正反应为放热反应,(四物质均为气体).达到平衡时.VA=1.2a L,试回答:(A在的活塞可移动)
如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y,起始时VA=VB=aL.在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y?2Z+W;正反应为放热反应,(四物质均为气体).达到平衡时.VA=1.2a L,试回答:(A在的活塞可移动)(1)A中的X的转化率 αA=
40%
40%
;(2)A、B中X的转化率αA
>
>
αB (填“>、=、<”)(3)打开K,一段时间后又达到平衡时,A 的体积为
2.6a
2.6a
L(连通管中的气体体积不计)已知T K和P kPa时,在一密闭容器中充有1mol A和1mol B,此时容器的体积为V L,保持恒温恒压,使反应:A(g)+B(g)?C(g)达到平衡时,C的物质的量分数为40%.试回答下列有关问题:
(1)如使温度和压强在上述条件下恒定不变,在密闭容器中充入2mol A和2mol B,则反应达到平衡时,容器的体积为
VL
VL,C的物质的量分数为
(2)若另选一容积固定不变的密闭容器,仍然控制温度为T K,使1mol A和1mol B反应达到平衡状态时,C的物质的量分数仍然为40%,则该密闭容器的体积为
VL
VL.
查看习题详情和答案>>
(1)如使温度和压强在上述条件下恒定不变,在密闭容器中充入2mol A和2mol B,则反应达到平衡时,容器的体积为
| 10 |
| 7 |
| 10 |
| 7 |
40%
40%
;(2)若另选一容积固定不变的密闭容器,仍然控制温度为T K,使1mol A和1mol B反应达到平衡状态时,C的物质的量分数仍然为40%,则该密闭容器的体积为
| 5 |
| 7 |
| 5 |
| 7 |
(2011?西安模拟)一定温度下,在一个带有活塞的容积可变的密闭容器中(活塞的一端与大气相通),发生如下反应:X(g)+3Y(g)
=2Z(g)△H<0若反应开始时充入2molX和8molY,达到平衡后,测得平衡时混合气体的总物质的量为8.4mol,X的体积分数为w%.
(1)写出该反应平衡常数的表达式
(2)若增大压强,该反应的化学反应速率将
(3)保持上述反应温度不变,设a、b、c分别代表初始加入的X、Y、Z的物质的量,若反应达平衡后,混合气体中x的体积分数仍为w%,那么:
若a=1,c=2,则b=
(4)保持上述反应温度不变,若按下列四种配比作为起始物质,达平衡后X的体积分数大于w%的是
A.4molZ B.2.5molX、4.5molY和 1molZ
C.3molX和 6molY D.1molX和 4molZ.
查看习题详情和答案>>
| ||
(1)写出该反应平衡常数的表达式
K=
| c2(Z) |
| c(X)?c3(Y) |
K=
,并计算平衡时X的转化率| c2(Z) |
| c(X)?c3(Y) |
40%
40%
.(2)若增大压强,该反应的化学反应速率将
增大
增大
,该反应的K值将不变
不变
(均填“增大”“减小”或“不变”).(3)保持上述反应温度不变,设a、b、c分别代表初始加入的X、Y、Z的物质的量,若反应达平衡后,混合气体中x的体积分数仍为w%,那么:
若a=1,c=2,则b=
5
5
,在此情况下反应起始时将向逆反应
逆反应
方向进行.(4)保持上述反应温度不变,若按下列四种配比作为起始物质,达平衡后X的体积分数大于w%的是
ABCD
ABCD
.(填序号)A.4molZ B.2.5molX、4.5molY和 1molZ
C.3molX和 6molY D.1molX和 4molZ.
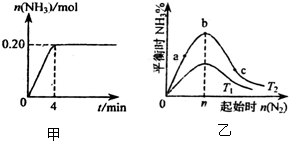 合成氨反应的热化学方程式为N2(g)+3H2(g)?2NH3(g);△H=-92kJ/mol.向一个容积为2L的密闭容器中加入xmolN2和ymolH2,在一定条件下发生反应.
合成氨反应的热化学方程式为N2(g)+3H2(g)?2NH3(g);△H=-92kJ/mol.向一个容积为2L的密闭容器中加入xmolN2和ymolH2,在一定条件下发生反应.(1)反应过程中测得NH3的物质的量随时间变化情况如图甲所示,请计算:
①从反应开始到平衡这段时间内,
. |
| v |
0.0375mol?L-1?min-1
0.0375mol?L-1?min-1
;反应过程中放出的热量是9.2
9.2
kJ.②若平衡后容器中还有0.1molN2、0.2molH2,则N2的转化率为
50%
50%
,NH3的体积分数φ=40%
40%
.(2)向上述密闭容器中再通入zmolNH3,保持温度和压强不变,要使平衡混合物中NH3的体积分数仍为φ,还需加入N2
| z |
| 10 |
| z |
| 10 |
(3)在其他条件不变的情况下,改变N2的起始物质的量n(N2) 对反应的影响如图乙所示(T表示温度),请回答:
①若T1对应温度为500℃,则T2对应温度可能是
D
D
(填字母).A.600℃;B.550℃;C.500℃;D.450℃
②在a、b、c三点所处的平衡状态中,反应物H2转化率最高的是
c
c
点.影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示.
试回答:实验1、2研究的是其他条件相同时
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察
②定量分析:为了更精确地研究浓度对反应速率的影响,利用乙图装置进行定量实验.完成该实验应该测定的实验数据是

查看习题详情和答案>>
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示.
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
温度
温度
对H2O2分解速率的影响.(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察
反应产生气泡的快慢
反应产生气泡的快慢
,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除阴离子的干扰
排除阴离子的干扰
.②定量分析:为了更精确地研究浓度对反应速率的影响,利用乙图装置进行定量实验.完成该实验应该测定的实验数据是
测定一定时间内产生的气体(或测定产生一定体积的气体所需的时间).
测定一定时间内产生的气体(或测定产生一定体积的气体所需的时间).
.