摘要:将石墨电极A和B.浸入盛有200g10%的硝酸银溶液的烧杯中.将直流电源P.Q两极分别与A.B相连.通电一段时间后.A极因附着析出物质.而增至2.16g.则B极逸出气体质量为 g,电源的P极是 极.A极发生 反应.电解反应式为 .此时硝酸银溶液的质量百分比浓度为 .
网址:http://m.1010jiajiao.com/timu3_id_254423[举报]
将石墨电极A和B,浸入盛有200
g 10%的硝酸银溶液的烧杯中,将直流电源P与Q两极分别与A和B相连,通电一段时间后,A极因附着析出物质,而增重2.16 g.
(1)B极逸出的气体质量是多少g?
(2)电源P极是______极,A极发生______反应,电极反应式为________________.
(3)求此时AgNO3溶液的质量分数.
查看习题详情和答案>>
 (1)阿波罗宇宙飞船使用的是碱性氢氧燃料电池,负极贮存的是氢气,正极贮存的是氧气,电解质是NaOH溶液.请写出该反应发生的电极反应式.
(1)阿波罗宇宙飞船使用的是碱性氢氧燃料电池,负极贮存的是氢气,正极贮存的是氧气,电解质是NaOH溶液.请写出该反应发生的电极反应式.正极:
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;负极:2H2+4OH--4e-=4H2O
2H2+4OH--4e-=4H2O
;总反应:2H2+O2=2H2O
2H2+O2=2H2O
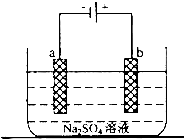
.(2)如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.
①a电极上的电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
;②在b极附近观察到的现象是
有气泡冒出,溶液显红色
有气泡冒出,溶液显红色
;③电解一段时间后,加入适量
H2O
H2O
可以使电解质溶液恢复到原来的浓度.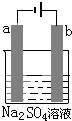 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是( )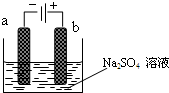 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加几滴石蕊溶液.下列实验现象中正确的是( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加几滴石蕊溶液.下列实验现象中正确的是( )