摘要:金属具有优良的导热性.原因是 A.金属受热时易熔化为液态.液体易流动.传热性能好 B.金属离子有优良的导热性能 C.热量易在金属内部形成对流 D.自由电子受热时能量增加.运动速度加快.通过碰撞将能量 传递给其它金属离子或电子
网址:http://m.1010jiajiao.com/timu3_id_253345[举报]
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
![]()
下列叙述中正确的是( )
A.在氮化铝的合成反应中,C是还原剂,N2是氧化剂
B.氮化铝中氮元素的化合价为―3
C.因为具有抗冲击、导热性好等优良性能.所以氮化铝属于金属材料
D.合成氮化铝的反应符合“绿色化学”的思想
查看习题详情和答案>>(15分)氮的化合物在无机化工领域有着重要的地位。请回答下列问题:
(1)基态氮原子的价电子排布图为______。氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化轨道类型为 。
(2)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气与氧化铝和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,工业制备X的化学方程式为____。

(3)X晶体中包含的化学键类型为______。(填字母标号)
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是______
(5)若X的密度为pg/cm3,则晶体中最近的两个N原子的距离为______cm(阿伏加德罗常数用NA表示,不必化简)。
(1)基态氮原子的价电子排布图为______。氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化轨道类型为 。
(2)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气与氧化铝和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,工业制备X的化学方程式为____。

(3)X晶体中包含的化学键类型为______。(填字母标号)
| A.离子键 | B.共价键 | C.配位键 | D.金属键 |
(5)若X的密度为pg/cm3,则晶体中最近的两个N原子的距离为______cm(阿伏加德罗常数用NA表示,不必化简)。
 因在石墨烯材料方面的卓越研究,2010年诺贝尔物理学奖授予英国两位科学家.石墨烯是碳原子构成的单层二维蜂窝状晶格结构(如图所示)的一种碳单质新材料,是构建富勒烯、纳米碳管的基本单元.利用石墨烯制造晶体管,有可能最终替代现有的硅材料,石墨烯还可用于制造透明的触摸显示屏、发光板和太阳能电池板.下列说法不正确的是
因在石墨烯材料方面的卓越研究,2010年诺贝尔物理学奖授予英国两位科学家.石墨烯是碳原子构成的单层二维蜂窝状晶格结构(如图所示)的一种碳单质新材料,是构建富勒烯、纳米碳管的基本单元.利用石墨烯制造晶体管,有可能最终替代现有的硅材料,石墨烯还可用于制造透明的触摸显示屏、发光板和太阳能电池板.下列说法不正确的是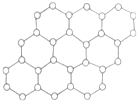 因在石墨烯材料方面的卓越研究,2010年诺贝尔物理学奖授予英国两位科学家.石墨烯是碳原子构成的单层二维蜂窝状晶格结构(如图所示)的一种碳单质新材料,是构建富勒烯、纳米碳管的基本单元.利用石墨烯制造晶体管,有可能最终替代现有的硅材料,石墨烯还可用于制造透明的触摸显示屏、发光板和太阳能电池板.下列说法不正确的是( )
因在石墨烯材料方面的卓越研究,2010年诺贝尔物理学奖授予英国两位科学家.石墨烯是碳原子构成的单层二维蜂窝状晶格结构(如图所示)的一种碳单质新材料,是构建富勒烯、纳米碳管的基本单元.利用石墨烯制造晶体管,有可能最终替代现有的硅材料,石墨烯还可用于制造透明的触摸显示屏、发光板和太阳能电池板.下列说法不正确的是( )