摘要:把一定量的FeS放入100mL2.0mol•L-1的盐酸中.以制备H2S.FeS完全溶解后.共收集到1.10LH2S气体.溶液中H2S的浓度为0.010mol•L-1.假定溶液的体积不变.试计算反应生成H2S的物质的量为 .反应后溶液中Fe2+的物质的量浓度为 .反应后溶液中剩余HCl的物质的量为 .反应后溶液中H+的物质的量浓度为 .
网址:http://m.1010jiajiao.com/timu3_id_253179[举报]
短周期元素T、Q、R、W、Z在元素周期表中的位置如图1所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
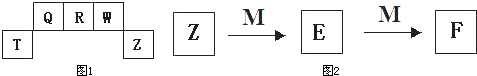
(1)Q 的气态氢化物的分子式为 .其分子的空间结构为 结构.
(2)Z 元素比R 元素的非金属性强.能证明这一结论的事实是 (填序号).
①相同条件下,Z 单质在水中的溶解性强于R 单质
②Z单质与氢气化合比R 单质与氢气化合容易
③Z 的氢化物比R 的氢化物稳定
(3)向T、Z元素形成的化合物的溶液中逐滴加入NaOH 溶液,先产生白色沉淀;继续滴加NaOH溶液,直至沉淀溶解.写出沉淀溶解的反应离子方程式: .
(4)QW 和RW都是汽车尾气中含有的大气污染物,它们在汽车排气管的“催化转换器”中反应生成可参与大气生态循环的无毒气体,化学方程式为 .
(5)M是一种常见的金属单质,与元素Z的单质有如图2所示转化关系,则E转化为F的反应的离子方程式是 .
把一定量的M 放入E溶液中,完全反应后,所得溶液中E、F的物质的量相等,则已反应的E与未反应的E的物质的量之比为 .
查看习题详情和答案>>
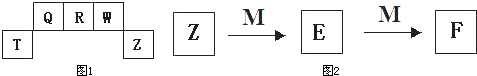
(1)Q 的气态氢化物的分子式为
(2)Z 元素比R 元素的非金属性强.能证明这一结论的事实是
①相同条件下,Z 单质在水中的溶解性强于R 单质
②Z单质与氢气化合比R 单质与氢气化合容易
③Z 的氢化物比R 的氢化物稳定
(3)向T、Z元素形成的化合物的溶液中逐滴加入NaOH 溶液,先产生白色沉淀;继续滴加NaOH溶液,直至沉淀溶解.写出沉淀溶解的反应离子方程式:
(4)QW 和RW都是汽车尾气中含有的大气污染物,它们在汽车排气管的“催化转换器”中反应生成可参与大气生态循环的无毒气体,化学方程式为
(5)M是一种常见的金属单质,与元素Z的单质有如图2所示转化关系,则E转化为F的反应的离子方程式是
把一定量的M 放入E溶液中,完全反应后,所得溶液中E、F的物质的量相等,则已反应的E与未反应的E的物质的量之比为