网址:http://m.1010jiajiao.com/timu3_id_251631[举报]
(1)用盐酸进行滴定之前不需要过滤以除去BaCO3的理由是________________________;
(2)达到终点时,溶液的颜色变化是_____________;
(3)达到终点时消耗25.0 mL的HCl,则原混合液中NaOH的含量为_____________ g·mL-1;
(4)若向含有大量BaCO3固体的浊液中,分别加入下列试剂,则发生的变化是:
①加入少量BaCl2固体,则c(Ba2+)_____________,c (![]() )_____________。(填“增大”“减小”)。
)_____________。(填“增大”“减小”)。
②加入少量稀盐酸,则Ksp(BaCO3)_____________(填“增大”“减小”或“不变”)。
查看习题详情和答案>>(9分)pH=12的NaOH溶液100ml,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL。
(2)如果加入pH=10的NaOH溶液,就加 mL。
(3)如果加0.01mol/L的HC1,应加 mL。
【解析】考查pH的计算。
(1)若加水稀释。强碱每稀释10n倍,强碱的pH就减小n个单位,pH由12变为11,则相当于稀释10倍,及最终溶液的体积是1000ml,所以需要水1000ml-100ml=900ml。
(2)若加入强碱。PH=11,则混合后OH-的物质的量浓度为0.001mol/L。所以有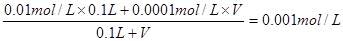 ,解得V=1L.
,解得V=1L.
(3)若加入盐酸,则发生中和反应。因此 ,解得V=0.0818L。
,解得V=0.0818L。
查看习题详情和答案>>
(9分)pH=12的NaOH溶液100ml,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL。
(2)如果加入pH=10的NaOH溶液,就加 mL。
(3)如果加0.01mol/L的HC1,应加 mL。
【解析】考查pH的计算。
(1)若加水稀释。强碱每稀释10n倍,强碱的pH就减小n个单位,pH由12变为11,则相当于稀释10倍,及最终溶液的体积是1000ml,所以需要水1000ml-100ml=900ml。
(2)若加入强碱。PH=11,则混合后OH-的物质的量浓度为0.001mol/L。所以有 ,解得V=1L.
,解得V=1L.
(3)若加入盐酸,则发生中和反应。因此![]() ,解得V=0.0818L。
,解得V=0.0818L。
查看习题详情和答案>>
CH3COOH?CH3COO-+H+△H>0.
(1)常温下,在 pH=5的稀醋酸溶液中,c(CH3COO-)=
a.加入少量0.10mol?L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol?L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol?L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:
(4)常温下,将0.1mol/L盐酸和0.1mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为
(5)已知:90℃时,水的离子积常数为Kw=3.8×10-13,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=
(1)常温常压下,在 pH=5的稀醋酸溶液中,c(CH3COO-)=
a.加入少量0.10mol?L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol?L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol?L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V盐酸
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是: