网址:http://m.1010jiajiao.com/timu3_id_250977[举报]
下列各反应达到化学平衡后,减小压强或升高温度,Z的物质的量都会增大的是( )
A. ![]()
![]()
![]() (正反应为放热反应)
(正反应为放热反应)
B. ![]()
![]()
![]() (正反应为吸热反应)
(正反应为吸热反应)
C. ![]()
![]()
![]() (正反应为吸热反应)
(正反应为吸热反应)
D. ![]()
![]()
![]() (正反应为吸热反应)
(正反应为吸热反应)
下列化学反应达到平衡后,增大压强或升高温度,平衡都向右移动的是
[ ]
A.2NO2 N2O4,正反应方向是放热反应
N2O4,正反应方向是放热反应
B.3O2 2O3,正反应方向是吸热反应
2O3,正反应方向是吸热反应
C.H2(g)+I2(g) 2HI(g),正反应方向是放热反应
2HI(g),正反应方向是放热反应
D.NH4HCO3(s) NH3(g)+H2O(g)+CO2(g),正反应方向是吸热反应
NH3(g)+H2O(g)+CO2(g),正反应方向是吸热反应
①N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.
②4NH3(g)+5O2(g)
| ||
| △ |
(1)在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量
(2)反应②的化学平衡常数表达式K=
(3)在0.5L的密闭容器中,加入2.5mol N2 和 7.5mol H2,当该反应达到平衡时,测出平衡混合气的总物质的量为6mol,则平衡时氮气的转化率=
(4)为有效提高氢气的转化率,理论上可采取的措施有
A.升高温度 B.及时移出氨 C.增大压强 D.减小压强 E.循环利用和不断补充氮气.
①N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.
②4NH3(g)+5O2(g)
| ||
| △ |
(1)在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是______;
(2)反应②的化学平衡常数表达式K=______,温度降低时,K值______(填“增大”、“减小”或“无影响”);
(3)在0.5L的密闭容器中,加入2.5molN2和7.5molH2,当该反应达到平衡时,测出平衡混合气的总物质的量为6mol,则平衡时氮气的转化率=______
(4)为有效提高氢气的转化率,理论上可采取的措施有______;
A.升高温度B.及时移出氨C.增大压强D.减小压强 E.循环利用和不断补充氮气.
(14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
(1)判断反应达到平衡状态的依据是(填字母序号,下同)__________。
A. 生成的速率与消耗
的速率相等
B. 混合气体的密度不变
C. 混合气体的相对平均分子质量不变
D. 、
、
的浓度都不再发生变化
E. 气体的压强不再改变
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H__________0(填“>”、“=”或“<”);
②某温度下,将和
充入
的密闭容器中,充分反应后,达到平衡时测得
,则CO的转化率为__________,此时的温度为__________。
(3)要提高CO的转化率,可以采取的措施是__________。
a. 升温 b. 加入催化剂 c.增加CO的浓度
d. 恒容下加入 使压强变大 e. 恒容下加入惰性气体使压强变大 f. 分离出甲醇
(4)在250℃时,某时刻测得该温度下的密闭容器中各物质的物质的量浓度见下表:
| CO | | |
| 0.5 mol·L—1 | 2mol·L—1 | 6mol·L—1 |
此时反应的正、逆反应速率的关系是:v(正) v(逆)(填“大于”“小于”或“等于”)。
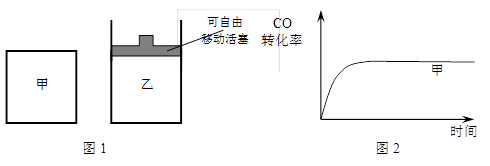
(5)如图1所示,甲为恒容密闭容器,乙为恒压密闭容器。在甲、乙两容器中分别充入等物质的量的H2和CO,使甲、乙两容器初始容积相等。在相同温度下发生上述反应,并维持反应过程中温度不变。已知甲容器中CO的转化率随时间变化的图像如图2所示,请在图2中画出乙容器中CO的转化率随时间变化的图像。
查看习题详情和答案>>