摘要:3.磷酸
网址:http://m.1010jiajiao.com/timu3_id_250549[举报]
磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-、和PO43-四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
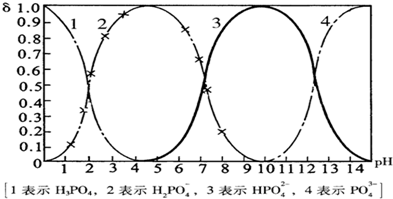
(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为
(3)从图中推断NaH2PO4溶液呈
(4)在Na3PO4溶液中,c(Na+)/c(PO43-)
查看习题详情和答案>>

(1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式
c(总)=c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)
c(总)=c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)
.(2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为
HPO42-+H+═H2PO4-
HPO42-+H+═H2PO4-
.当pH=7时,溶液中主要存在的阴离子(OH-离子除外)是H2PO4-、HPO42-
H2PO4-、HPO42-
.(3)从图中推断NaH2PO4溶液呈
酸
酸
性(填“酸”、“碱”、或“中”),其原因是H2PO4-在溶液中的电离程度大于水解程度
H2PO4-在溶液中的电离程度大于水解程度
.(4)在Na3PO4溶液中,c(Na+)/c(PO43-)
>
>
3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是KOH抑制了PO43-的水解
KOH抑制了PO43-的水解
.磷酸铁锂电池(LPF)是一种新型钮电池,其正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质,化学方程式为:LiC+xFePO4
xLiFePO4+C.下列说法正确的是( )
| 放电 |
| 充电 |
查看习题详情和答案>>
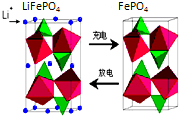 磷酸铁锂电池是一种新型锂离子电池,其正极材料为LiFePO4,充放电时的变化如图示,负极充、放电时的变化可简化为:LixC
磷酸铁锂电池是一种新型锂离子电池,其正极材料为LiFePO4,充放电时的变化如图示,负极充、放电时的变化可简化为:LixC| 放电 |
| 充电 |
下列有关说法正确的是( )
| A、该电池属于二次电池 |
| B、LiFePO4中铁为+2价 |
| C、充电时电池正极的电极反应为:FePO4+Li++e-→LiFePO4 |
| D、放电时,Li+向负极移动 |
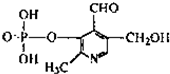 磷酸吡醛素是细胞重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯,其结构式如图.下列说法错误的是( )
磷酸吡醛素是细胞重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯,其结构式如图.下列说法错误的是( )| A、该酯分子式为C8H9O6NP | B、该酯能使石蕊试液变红 | C、该酯能与金属钠反应 | D、该酯能与乙醇发生酯化反应 |