网址:http://m.1010jiajiao.com/timu3_id_249876[举报]
(6分)、右图是研究外界因素对过氧化氢分解反应速率影响的实验装置图。某学生研究小组在50mL量筒中盛满水,倒置于水槽中,通过分液漏斗把过氧化氢溶液加入锥形瓶中(内中已有适量二氧化锰催化剂),记录各时间段在室温下收集到的氧气的体积。
第1组:粉末状的二氧化锰0.2g+ 5ml 6% H2O2
第2组:粉末状的二氧化锰0.2g+ 3ml 12% H2O2
第3组:粉末状的二氧化锰0.1g+ 5ml 6% H2O2[来源:ZXXK]
第4组:颗粒状的二氧化锰0.1g+ 5ml 6% H2O2
| 催化剂:MnO2 | 第1组 | 第2组 | 第3组 | 第4组 |
| 前15s产生氧气的量(ml) | 11 | 15 | 8 | 7 |
| 前30s产生氧气的量(ml) | 21 | 24 | 11 | 9 |
| 前45s产生氧气的量(ml) | 31 | 35 | 18 | 12 |
| 前60s产生氧气的量(ml) | 45 | 48 | 26 | 15 |
(1)写出H2O2分解的反应方程式: ;
(2)从实验的几组数据中能得到的是: ;
(3)实验比较反应速率时可以测定相同时间内产生气体的体积,也可测 。
查看习题详情和答案>>
(6分)、右图是研究外界因素对过氧化氢分解反应速率影响的实验装置图。某学生研究小组在50mL量筒中盛满水,倒置于水槽中,通过分液漏斗把过氧化氢溶液加入锥形瓶中(内中已有适量二氧化锰催化剂),记录各时间段在室温下收集到的氧气的体积。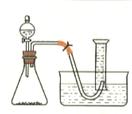
第1组:粉末状的二氧化锰0.2g+ 5ml 6% H2 O2
O2
第2组:粉末状的二氧化锰0.2g+ 3ml 12% H2O2
第3组:粉末状的二氧化锰0.1g+ 5ml 6% H2O2[来源:学科网ZXXK]
第4组:颗粒状的二氧化锰0.1g+ 5ml 6% H2O2
| 催化剂:MnO2 | 第1组 | 第2组 | 第3组 | 第4组 |
| 前15s产生氧气的量(ml) | 11 | 15 | 8 | 7 |
| 前30s产生氧气的量(ml) | 21 | 24 | 11 | 9 |
| 前45s产生氧气的量(ml) | 31 | 35 | 18 | 12 |
| 前60s产生氧气的量(ml) | 45 | 48 | 26 | 15 |
(2)从实验的几组数据中能得到的是: ;
(3)实验比较反应速率时可以测定相同时间内产生气体的体积,也可测 。 查看习题详情和答案>>
(6分)、右图是研究外界因素对过氧化氢分解反应速率影响的实验装置图。某学生研究小组在50mL量筒中盛满水,倒置于水槽中,通过分液漏斗把过氧化氢溶液加入锥形瓶中(内中已有适量二氧化锰催化剂),记录各时间段在室温下收集到的氧气的体积。

第1组:粉末状的二氧化锰0.2g+ 5ml 6% H2O2
第2组:粉末状的二氧化锰0.2g+ 3ml 12% H2O2
第3组:粉末状的二氧化锰0.1g+ 5ml 6% H2O2[来源:ZXXK]
第4组:颗粒状的二氧化锰0.1g+ 5ml 6% H2O2
|
催化剂:MnO2 |
第1组 |
第2组 |
第3组 |
第4组 |
|
前15s产生氧气的量(ml) |
11 |
15 |
8 |
7 |
|
前30s产生氧气的量(ml) |
21 |
24 |
11 |
9 |
|
前45s产生氧气的量(ml) |
31 |
35 |
18[来源:] |
12 |
|
前60s产生氧气的量(ml) |
45 |
48 |
26 |
15 |
(1)写出H2O2分解的反应方程式: ;
(2)从实验的几组数据中能得到的是: ;
(3)实验比较反应速率时可以测定相同时间内产生气体的体积,也可测 。
查看习题详情和答案>>
、右图是研究外界因素对过氧化氢分解反应速率影响的实验装置图。某学生研究小组在50mL量筒中盛满水,倒置于水槽中,通过分液漏斗把过氧化氢溶液加入锥形瓶中(内中已有适量二氧化锰催化剂),记录各时间段在室温下收集到的氧气的体积。

第1组:粉末状的二氧化锰0.2g+ 5ml 6% H2O2
第2组:粉末状的二氧化锰0.2g+ 3ml 12% H2O2
第3组:粉末状的二氧化锰0.1g+ 5ml 6% H2O2[来源:ZXXK]
第4组:颗粒状的二氧化锰0.1g+ 5ml 6% H2O2
| 催化剂:MnO2 | 第1组 | 第2组 | 第3组 | 第4组 |
| 前15s产生氧气的量(ml) | 11 | 15 | 8 | 7 |
| 前30s产生氧气的量(ml) | 21 | 24 | 11 | 9 |
| 前45s产生氧气的量(ml) | 31 | 35 | 18 | 12 |
| 前60s产生氧气的量(ml) | 45 | 48 | 26 | 15 |
 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1 H2C2O4溶液 |
30mL 0.01mol?L-1 KMnO4溶液 |
| ② | 20mL 0.2mol?L-1 H2C2O4溶液 |
30mL 0.01mol?L-1 KMnO4溶液 |
(2)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速 率变快的主要原因可能是:①该反应放热、②