网址:http://m.1010jiajiao.com/timu3_id_249873[举报]
X、Y、Z均为短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气体),Y+Z→B(气体)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,A和B化合时有白烟产生,德国化学家哈伯因为研究A的工业合成曾两度获得诺贝尔奖,则:
①有人说,哈伯解决了全世界人的吃饭问题,请你说说对这句话的理解 。
②A与氧气反应生成C和D,是化工生产上的重要反应,写出该反应的化学方程式 ,C是大气污染物,说出一种C造成污染的现象 ,
③将C与A混合,在一定条件下可转化为无毒的X和D,该反应中氧化产物与还原产物的质量之比为 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是 ;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是 ;
③将Y与(1)中Z单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是 。
X、Y、Z均为短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气体),Y+Z→B(气体)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,A和B化合时有白烟产生,德国化学家哈伯因为研究A的工业合成曾两度获得诺贝尔奖,则:
①有人说,哈伯解决了全世界人的吃饭问题,请你说说对这句话的理解 。
②A与氧气反应生成C和D,是化工生产上的重要反应,写出该反应的化学方程式 ,C是大气污染物,说出一种C造成污染的现象 ,
③将C与A混合,在一定条件下可转化为无毒的X和D,该反应中氧化产物与还原产物的质量之比为 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是 ;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是 ;
③将Y与(1)中Z单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是 。
查看习题详情和答案>> (2009?清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)?2NH3(g) 已知298K时:△H=-92.4kJ?mol-1试回答下列问题:
(2009?清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)?2NH3(g) 已知298K时:△H=-92.4kJ?mol-1试回答下列问题:(1)在298K时,将10mol N2和30mol H2放入合成塔中,为何放出的热量小于924kJ?
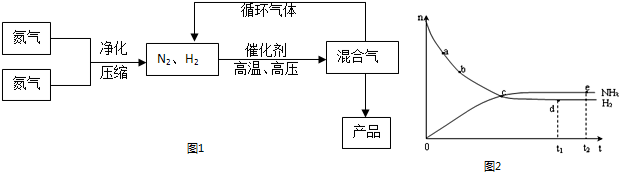
(2)如图一在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答:
①N2的转化率αA为
②在状态A时,平衡常数KA=
| 0.082 |
| 0.06×0.183 |
| 0.082 |
| 0.06×0.183 |
(3)图二是实验室模拟工业法合成氨的简易装置.简述检验有氨气生成的方法
反应体系中各组分的部分性质见下表:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
(2)工业上采取用上述(1)操作的目的:
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(4)合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图2所示.下列叙述正确的是
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图2中d点的值大.
(Ⅰ)德国人哈伯在1905年发明的合成氨反应原理为:N2(g)+3H2(g) ![]() 2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1.试回答下列问题:
2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1.试回答下列问题:
(1)请根据正反应的焓变和熵变计算分析298 K下合成氨反应能自发进行(列出算式即可)___________________.其浓度熵(Qc) __________________化学平衡常数(Kc)(填“大于”“等于”或“小于”)时,反应向右进行.
(2)在实际工业合成氨生产中采取的措施是__________________ (填序号).
A.采用较低压强
B.采用800 K左右的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(3)如下图所示是实验室模拟工业法合成氨的简易装置,简述检验有氨气生成的方法
___________________________________________________________________________
___________________________________________________________________________.

(Ⅱ)硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取.某校化学兴趣小组的同学设计了如下图所示装置利用中学实验室常见试剂制取NH3,并以空气,NH3为原料模拟工业制HNO3(三氧化二铬为催化剂,加热及夹持装置未画出):

回答下列问题:
(1)实验时,A,C两装置均需加热,应先加热______________装置,原因是___________________;
(2)D装置中应填充的物质是______________,该物质的主要作用是______________;
(3)E装置的作用是______________,F,G装置中的物质分别是______________、______________;
(4)若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在如下图所示的方框中画出装置图并注明所用药品的名称).
