摘要: 今将氮气与氢气按一定比例混合,其混合气对氢气的相对密度是3.6,取0.5mol该混合气装入密闭容器内,使之发生反应并在一定条件下达到平衡.已知反应达平衡后容器内压强是相同条件下反应前压强的0.76倍. 求:(1)反应前混合气中氮气与氢气的体积比是 ;(2)达平衡时混合气中氨的物质的量是 mol;(3)平衡时氮气的转化率是 %.
网址:http://m.1010jiajiao.com/timu3_id_249544[举报]
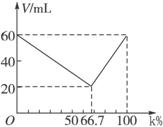
通常状况下,分子式为CnHm的气态烃A在一定条件下跟氢气发生加成反应并生成CnHm+y。将A与氢气按不同的比例混合,反应后混合气体的总体积(V)随氢气在原混合气体中的体积分数(x%)的变化如下图所示,则A分子的结构简式可能为______________。
在一定温度、压强和有催化剂存在时,将氮气和氢气按1:3(体积比)混和,当反应达到平衡时混合气体中氨气占25%(体积比).如果混和前氮气为100 mol,达到平衡时:
(1)n(N2)= mol;n(H2)= mol;n(NH3)= mol。
(2)N2的转化率为 。
查看习题详情和答案>>在一定温度、压强和有催化剂存在时,将氮气和氢气按1∶3(体积比)混和,当反应达到平衡时,混合气体中氨气占25%(体积比).如果混和前氮气为100 mol,达到平衡时:
(1)n(N2)=________mol;n(H2)=________mol;n(NH3)=________mol.
(2)N2的转化率为________.
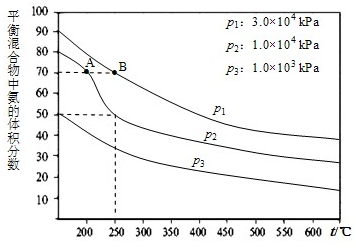 在工业合成尿素时常用NH3与CO2作原料进行生产.
在工业合成尿素时常用NH3与CO2作原料进行生产.(1)右图为合成氨反应,氮气、氢气按体积比为1:3投料时不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数图象.
①若分别用υA(NH3)和υB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则υA(NH3)
②在250℃、1.0×104kPa下,H2的转化率为
③将0.02mol?L-1氨水与0.01mol?L-1的盐酸等体积混合,若反应后混合溶液显碱性,则反应混合液中各离子浓度由大到小的顺序为
(2)NH3(g) 与CO2(g) 经过两步反应生成尿素,两步反应的能量变化示意图如下:
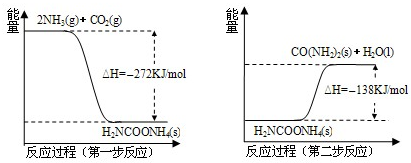
①NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为
②工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有
A.升高温度 B.加入催化剂 C.将尿素及时分离出去 D.增大反应体系的压强
(3)某实验小组模拟工业上合成尿素的条件,在一体积为0.5L的密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图所示:
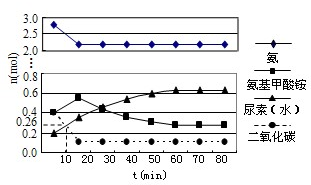
①已知总反应的速率通常由慢的一步反应决定,则合成尿素总反应的速率由第
②反应进行到10min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=
化学变化中既有物质变化,也有能量变化,研究化学反应有利于指导工业生产.下列是常见的化学反应:①电解熔融氯化钠 ②氮气与氢气合成氨气 ③锌与稀硫酸反应 ④煅烧石灰石.
(1)从不同角度可以对上述反应进行分类:从反应前后能量变化角度看上述反应属于放热反应的是
(2)反应③在实验室中用于制备氢气,要提高生成氢气的速率下列措施合理的是
a.加入硝酸,增大氢离子的浓度 b.用浓硫酸代替稀硫酸
c.加入少量铜粉 d.将稀硫酸的体积加倍.
反应③可以设计成原电池反应,其中负极上反应的物质是
(3)反应②是可逆反应,常应用于工业生产,升高温度正反应速率
查看习题详情和答案>>
(1)从不同角度可以对上述反应进行分类:从反应前后能量变化角度看上述反应属于放热反应的是
②③
②③
(填序号,下同);从有无电子转移角度看上述反应属于非氧化还原反应的是④
④
;从反应前后物质种类的变化角度看,①和④均属于分解
分解
反应;①和②在变化过程中断裂的化学键类型分别为离子键
离子键
、共价键
共价键
.(2)反应③在实验室中用于制备氢气,要提高生成氢气的速率下列措施合理的是
c
c
.a.加入硝酸,增大氢离子的浓度 b.用浓硫酸代替稀硫酸
c.加入少量铜粉 d.将稀硫酸的体积加倍.
反应③可以设计成原电池反应,其中负极上反应的物质是
锌
锌
,电子流向正
正
极.(3)反应②是可逆反应,常应用于工业生产,升高温度正反应速率
增大
增大
(填“增大”、“减小”或“不变”,下同),逆反应速率增大
增大
;请列举一项该反应达到平衡的标志正反应速率等于逆反应速率
正反应速率等于逆反应速率
.