摘要: 在容积为2L的容器中.放入A和B.在一定温度下.压强为P.放入催化剂发生反应..在后.容器中.此时.若温度与压强均未改变.则 . .若温度不变压强为.则 .
网址:http://m.1010jiajiao.com/timu3_id_248687[举报]
在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH2O(g)的混合气体,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
(1)1100℃时,前10min该反应的化学反应速率v(CO2)=
(2)1100℃时化学平衡常数K=
(3)能判断该反应是否达到化学平衡状态的依据是
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡
(5)830℃时,若在体积为2L的密闭容器中充入1molCO2和1molH2的混合气体,60min时反应达平衡状态,画出c(CO)和c(H2)随时间变化而变化的趋势图.
查看习题详情和答案>>
| 0min | 10min | 20min | 30min | 40min | 50min | |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
0.025mol/(L.min)
0.025mol/(L.min)
,830℃平衡后CO转化率的为50%
50%
.(2)1100℃时化学平衡常数K=
0.44
0.44
,该反应为放热
放热
反应(填“吸热”和“放热”).(3)能判断该反应是否达到化学平衡状态的依据是
bc
bc
.(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡
无此空
无此空
向正反应方向移动
向正反应方向移动
移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量不变
不变
(选填“增大”或“减小”或“不变”).(5)830℃时,若在体积为2L的密闭容器中充入1molCO2和1molH2的混合气体,60min时反应达平衡状态,画出c(CO)和c(H2)随时间变化而变化的趋势图.

在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH2O(g)的混合气体,进行如下化学反应:CO(g)+H2O(g)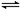 CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
| | 0min | 10min | 20min | 30min | 40min | 50min |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
(2)1100℃时化学平衡常数K=_______,该反应为________反应(填“吸热”和“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是____________________。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡_____________________移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量________________(选填“增大”或“减小”或“不变”)。
(5)830℃时,若在体积为2L的密闭容器中充入1molCO2和1molH2的混合气体,60min时反应达平衡状态,画出c(CO)和c(H2)随时间变化而变化的趋势图。
 查看习题详情和答案>>
查看习题详情和答案>>
在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH2O(g)的混合气体,进行如下化学反应:CO(g)+H2O(g)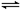 CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
(1)1100℃时,前10min该反应的化学反应速率v(CO2)= ,830℃平衡后CO转化率的为__________________。
(2)1100℃时化学平衡常数K=_______,该反应为________反应(填“吸热”和“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是____________________。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡_____________________移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量________________(选填“增大”或“减小”或“不变”)。
(5)830℃时,若在体积为2L的密闭容器中充入1molCO2和1molH2的混合气体,60min时反应达平衡状态,画出c(CO)和c(H2)随时间变化而变化的趋势图。
 CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:| | 0min | 10min | 20min | 30min | 40min | 50min |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
(2)1100℃时化学平衡常数K=_______,该反应为________反应(填“吸热”和“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是____________________。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡_____________________移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量________________(选填“增大”或“减小”或“不变”)。
(5)830℃时,若在体积为2L的密闭容器中充入1molCO2和1molH2的混合气体,60min时反应达平衡状态,画出c(CO)和c(H2)随时间变化而变化的趋势图。

A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
(3)A、B、D、E四种元素组成的某无机化合物浓度为0.1mol/L时,pH最接近
A.5.6B.7.0 C.8.4D.13.0
(4)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g)
2CA3(g)
△H=-92.4kJ?mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2mol,总容积为1.0L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是
A.C2 0.6mol,A2 0.5mol,CA3 0mol
B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L,CA3 0.2mol/L
②求算此平衡体系的平衡常数K=
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将
④已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65kJ的热量.写出该反应的热化学方程式
查看习题详情和答案>>
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是
10-4:1
10-4:1
.(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
Ba2++HCO3-+OH-═BaCO3↓+H2O
Ba2++HCO3-+OH-═BaCO3↓+H2O
.(3)A、B、D、E四种元素组成的某无机化合物浓度为0.1mol/L时,pH最接近
C
C
.A.5.6B.7.0 C.8.4D.13.0
(4)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)
 2CA3(g)
2CA3(g)△H=-92.4kJ?mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2mol,总容积为1.0L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是
BC
BC
:A.C2 0.6mol,A2 0.5mol,CA3 0mol
B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L,CA3 0.2mol/L
②求算此平衡体系的平衡常数K=
10
10
;③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将
逆向
逆向
(填“正向”、“逆向”或“不”)移动.理由是原平衡体系中,1.0L容器中含有分子0.5mol+0.2mol+0.2mol=0.9mol,当加入N2,体系瞬间有分子0.9mol+0.18ml=1.08mol,瞬间总体积为1.08×
=1.2L,所以:Q=
=
=10.59>10,平衡逆向移动
| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
原平衡体系中,1.0L容器中含有分子0.5mol+0.2mol+0.2mol=0.9mol,当加入N2,体系瞬间有分子0.9mol+0.18ml=1.08mol,瞬间总体积为1.08×
=1.2L,所以:Q=
=
=10.59>10,平衡逆向移动
.| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
④已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65kJ的热量.写出该反应的热化学方程式
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ?mol-1
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ?mol-1
.A、B、C、D四种元素原子的核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系:

(1)写出F的电子式
 .
.
(2)气体H有毒,可用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
(3)加热E的水溶液后并灼烧,最终得到的固体为
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的PH>7,则此溶液中离子浓度由小到大的顺序为:
(5)将气体H放在空气中充分燃烧可得到气体氧化物BO2,BO2可与氧气继续反应:2BO2+O2 2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=
2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=
查看习题详情和答案>>

(1)写出F的电子式


(2)气体H有毒,可用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
H2S+Na2CO3=NaHS+NaHCO3
H2S+Na2CO3=NaHS+NaHCO3
.(3)加热E的水溶液后并灼烧,最终得到的固体为
Al2O3
Al2O3
,原因为AlCl3+3H2O?Al(OH)3+3HCl
AlCl3+3H2O?Al(OH)3+3HCl
,2Al(OH)3
Al2O3+2H2O
| ||
2Al(OH)3
Al2O3+2H2O
.(用化学反应方程式来表示)
| ||
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的PH>7,则此溶液中离子浓度由小到大的顺序为:
[S2-]<[H+]<[OH-]<[HS-]<[Cl-]<[K+]
[S2-]<[H+]<[OH-]<[HS-]<[Cl-]<[K+]
.(5)将气体H放在空气中充分燃烧可得到气体氧化物BO2,BO2可与氧气继续反应:2BO2+O2
 2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=
2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=0.09
0.09
mol?L-1?min-1.若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于0.36mol和0.40mol
0.36mol和0.40mol
之间.