摘要:16.今有反应2X(气)+Y(气)2Z(气)右图表示该反应在t1时达到平衡.在t2时因改变某个条件而发生变化的曲线.则下图中的t2时改变的条件是( )D A.升高温度或降低Y的浓度 B.加入催化剂或增大X的浓度 C.缩小体积或降低X的浓度 D.降低温度或增大Y的浓度
网址:http://m.1010jiajiao.com/timu3_id_248092[举报]
 今有反应X(g)+Y(g)
今有反应X(g)+Y(g)![]() 2Z(g)(正反应放热),右图表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是( )
2Z(g)(正反应放热),右图表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是( )
A. 升高温度或降低Y的浓度
B. 加入催化剂或增大X的浓度
C. 降低温度或增大Y的浓度
D. 缩小体积或降低X的浓度
查看习题详情和答案>>电解原理在化学工业中有广泛应用.右图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)X的电极名称是
(2)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是
(3)若X、Y都是惰性电极,a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是
(4)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是
查看习题详情和答案>>

(1)X的电极名称是
阴极
阴极
(填写“阳极”或“阴极”).(2)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是
纯铜
纯铜
,Y电极的材料是粗铜
粗铜
.(3)若X、Y都是惰性电极,a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是
放出气体,溶液变红
放出气体,溶液变红
,Y极上的电极反应式为2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.(4)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是
D
D
.| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
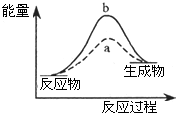 美国科学家理查德?赫克(Richard F,Heck)和日本科学家根岸英一(Ei-ichi Negishi)、铃木章(Akira Suzuki)因在有机合成领域中钯催化交叉偶联反应方面的卓越研究获诺贝尔化学奖.这一成果广泛应用于制药、电子工业和先进材料等领域,为化学家们提供“精致工具”,大大提升合成复杂化学物质的可能性.下列有关催化剂的表述错误的是( )
美国科学家理查德?赫克(Richard F,Heck)和日本科学家根岸英一(Ei-ichi Negishi)、铃木章(Akira Suzuki)因在有机合成领域中钯催化交叉偶联反应方面的卓越研究获诺贝尔化学奖.这一成果广泛应用于制药、电子工业和先进材料等领域,为化学家们提供“精致工具”,大大提升合成复杂化学物质的可能性.下列有关催化剂的表述错误的是( )| A、催化剂是改变化学反应速率最有效的手段之一 | B、催化剂自身的组成、化学性质和质量在反应前后不发生变化 | C、同一反应可以有不同的催化剂,同一催化剂也可用于不同的反应 | D、右图中b表示使用催化剂的情况,a表示无催化剂的情况 |
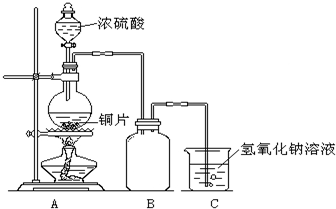 某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:
某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整.
(2)实验中他们取6.4g铜片和12mL18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余.
①写出铜与浓硫酸反应的化学方程式:
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
,
| ||
实验中若有m g铜参加了反应,则有
| m |
| 64 |
| m |
| 64 |
还原
还原
(填“氧化”或“还原”),转移电子的物质的量为| m |
| 32 |
| m |
| 32 |
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是
D
D
(填写字母编号).A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
稀硫酸不与铜反应
稀硫酸不与铜反应
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫.
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量.
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况).
实际上,以上方案一、二均不可取,请你说出原因?
方案一
产生的气体中含有水蒸气,干燥管中的质量差不仅仅是SO2的质量(或烧瓶中的二氧化硫不能完全排出)
产生的气体中含有水蒸气,干燥管中的质量差不仅仅是SO2的质量(或烧瓶中的二氧化硫不能完全排出)
;方案二
沉淀的质量一部分是高锰酸钾溶液中起酸化作用的硫酸与氯化钡反应而产生的
沉淀的质量一部分是高锰酸钾溶液中起酸化作用的硫酸与氯化钡反应而产生的
.方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL)
| V |
| 22.4×0.012 |
| V |
| 22.4×0.012 |
 甲、乙、丙、丁是由前20号元素组成的物质,有如下转化:甲+乙→丙+丁
甲、乙、丙、丁是由前20号元素组成的物质,有如下转化:甲+乙→丙+丁(1)若甲为块状固体,丙为分子内同时具有极性键和非极性键可燃性气体,乙为水,则丙的结构式
H-C≡C-H
H-C≡C-H
.(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,反应的离子方程式
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
.(3)霍夫曼根据上述反应,用右图实验装置测定了氨分子的组成.打开分液漏斗活塞,滴下浓氨水至不再反应为止;关闭活塞,待恢复至室温,打开止水夹,试管内液面上升至2/3处.①滴加浓氨水后试管内的现象
产生大量白烟,黄绿色气体消失
产生大量白烟,黄绿色气体消失
②相应的反应化学方程式8NH3+3Cl2=N2+6NH4Cl
8NH3+3Cl2=N2+6NH4Cl
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L Cl2(标状)时得到0.10mol氮的氯化物,丙的化学式
NCl3
NCl3
,反应方程式3Cl2+NH4Cl═NCl3+4HCl
3Cl2+NH4Cl═NCl3+4HCl
(5)某短周期金属元素的单质与核电荷数为其2倍的金属元素的氧化物之间也能发生上述反应,请写出相应的化学方程式
2Al+3FeO
Al2O3+3Fe或4Al+2Fe2O3
2Al2O3+4Fe或8Al+3Fe3O4
4Al2O3+9Fe
| ||
| △ |
| ||
| △ |
| ||
| △ |
2Al+3FeO
Al2O3+3Fe或4Al+2Fe2O3
2Al2O3+4Fe或8Al+3Fe3O4
4Al2O3+9Fe
.
| ||
| △ |
| ||
| △ |
| ||
| △ |