网址:http://m.1010jiajiao.com/timu3_id_247603[举报]
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ?mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)的△H=
(2)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=
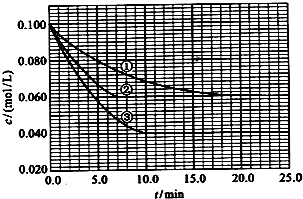
(3)在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
请回答下列问题:
与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:
②
③
该反应的△H
A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A与E、D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,A与B、C、D可分别形成10电子分子,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,请回答下列问题
(1)E、G两种元素的符号:E 、G ;F在元素周期表中的位置是 .
(2)Zn与稀硫酸反应需加入少量硫酸铜溶液反应速率会大大加快,其原理是 。
(3) E在D2中燃烧生成化合物X中阴阳离子个数比为 ;X中的阴离子电子式为 .
(4)能够说明可逆反应2CD2(g) 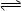 C2D4(g)达到平衡状态的标志是 ;
C2D4(g)达到平衡状态的标志是 ;
①单位时间消耗2mol CD2的同时,生成1 mol C2D4②恒温恒压下,混合气体的密度不变③CD2和C2D4的浓度之比为2∶1 ④混合气体的颜色不变⑤单位时间消耗4mol CD2的同时,消耗2mol C2D4
(5)向含E的最高价氧化物的水化物0.5 mol的水溶液中通入标况下BD2气体11.2L,其化学反应方程式为 。
(1)E、G两种元素的符号:E______、G______;F在元素周期表中的位置是______.
(2)Zn与稀硫酸反应需加入少量硫酸铜溶液反应速率会大大加快,其原理是______.
(3)E在D2中燃烧生成化合物X中阴阳离子个数比为______;X中的阴离子电子式为______.
(4)能够说明可逆反应2CD2(g)

C2D4(g)达到平衡状态的标志是______;
①单位时间消耗2mol CD2的同时,生成1mol C2D4
②恒温恒压下,混合气体的密度不变
③CD2和C2D4的浓度之比为2:1
④混合气体的颜色不变
⑤单位时间消耗4mol CD2的同时,消耗2mol C2D4
(5)向含E的最高价氧化物的水化物0.5mol的水溶液中通入标况下BD2气体11.2L,其化学反应方程式为______.
(1)E、G两种元素的符号:E______、G______;F在元素周期表中的位置是______.
(2)Zn与稀硫酸反应需加入少量硫酸铜溶液反应速率会大大加快,其原理是______.
(3)E在D2中燃烧生成化合物X中阴阳离子个数比为______;X中的阴离子电子式为______.
(4)能够说明可逆反应2CD2(g)
 C2D4(g)达到平衡状态的标志是______;
C2D4(g)达到平衡状态的标志是______;①单位时间消耗2mol CD2的同时,生成1mol C2D4
②恒温恒压下,混合气体的密度不变
③CD2和C2D4的浓度之比为2:1
④混合气体的颜色不变
⑤单位时间消耗4mol CD2的同时,消耗2mol C2D4
(5)向含E的最高价氧化物的水化物0.5mol的水溶液中通入标况下BD2气体11.2L,其化学反应方程式为______.
查看习题详情和答案>>
A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A与E、D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,A与B、C、D可分别形成10电子分子,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,请回答下列问题
(1)E、G两种元素的符号:E________、G________;F在元素周期表中的位置是________.
(2)Zn与稀硫酸反应需加入少量硫酸铜溶液反应速率会大大加快,其原理是________.
(3)E在D2中燃烧生成化合物X中阴阳离子个数比为________;X中的阴离子电子式为________.
(4)能够说明可逆反应2CD2(g)![]() C2D4(g)达到平衡状态的标志是________;
C2D4(g)达到平衡状态的标志是________;
①单位时间消耗2 mol CD2的同时,生成1 mol C2D4
②恒温恒压下,混合气体的密度不变
③CD2和C2D4的浓度之比为2∶1
④混合气体的颜色不变
⑤单位时间消耗4 mol CD2的同时,消耗2 mol C2D4
(5)向含E的最高价氧化物的水化物0.5 mol的水溶液中通入标况下BD2气体11.2 L,其化学反应方程式为________.