网址:http://m.1010jiajiao.com/timu3_id_246632[举报]

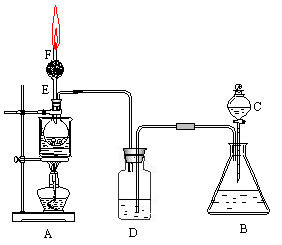
(1)B中逸出的气体主要成分是________________.
(2)D瓶的作用是____________________________.
(3)E管的作用是____________________________.
(4)F管口点燃的气体是______________________.
(5)A瓶中无水硫酸铜粉末变蓝的原因是_____________________________________.
(6)由A中发生的反应事实,可推断出的结论是_________________________________.
查看习题详情和答案>>
| |||||||||||||||||||||||
| |||||||||||||||||||||||
下图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水硫酸铜粉末,并另入约20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏半C和广口瓶D中分别盛浓硫酸;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏半的活塞后,由于浓硫酸流入B中,则D中导管口有些气泡产生.此时水浴加热,发生化学反应.过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出,点燃气体,有绿色焰.试回答:
(1)B逸出的主要气体名称__________.
(2)D瓶的作用是__________________.
(3)E管的作用是__________________.
(4)F管口点燃的气体分子式________.
(5)A瓶中无水硫酸铜粉末变蓝的原因是________.
(6)A中发生的方程式_____________.
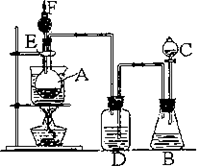
如下图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水硫酸铜粉末,并加入20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,由于浓H2SO4流入B中,则D中导管口有气泡产生.过几分钟后,无水硫酸铜粉末由无色变为蓝色.此时水浴加热后,发生化学反应,生成的气体从F处逸出,点燃气体,有绿色火焰.试回答:

(1)B中逸出的气体主要成分是________________.
(2)D瓶的作用是____________________________.
(3)E管的作用是____________________________.
(4)F管口点燃的气体是______________________.
(5)A瓶中无水硫酸铜粉末变蓝的原因是_____________________________________.
(6)由A中发生的反应事实,可推断出的结论是_________________________________.
查看习题详情和答案>>