摘要: 加热丙醛和氢氧化铜的混合物.生成砖红色沉淀.决定此实验成败的关键是 A. Cu(OH)2要新制的.CuSO4要过量 B. Cu(OH)2要新制的.NaOH要过量 C. Cu(OH)2要新制的.丙醛要过量 D. CuSO4和丙醛都要过量
网址:http://m.1010jiajiao.com/timu3_id_246418[举报]
(14分)甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成。常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物。试回答下列问题:
(1)甲的结构式 。
(2)甲是一种二元弱碱,则甲与过量硫酸反应的产物为 (写化学式)。16g甲在空气中充分燃烧,生成一种常见液态物质和氮气,放出311kJ热量,则其热化学方程式为 。
(3)甲和丙反应的产物中含有乙和一种气态单质,写出其化学方程式 。
(4)向乙的固体中加入过量硫酸酸化的硫酸铁溶液,乙固体完全溶解,得到透明溶液。
①写出其离子方程式 。
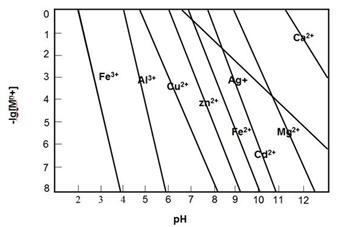
②若所得溶液中阳离子浓度均约为0.1mol/L,再向所得混合溶液中加丙,最先得到 沉淀(不同浓度的阳离子开始和完全以氢氧化物沉淀的pH如下图)。
③向上述混合液中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相) R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。请设计实验方案,验证有机相中含有铜元素。
R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。请设计实验方案,验证有机相中含有铜元素。
(1)甲的结构式 。
(2)甲是一种二元弱碱,则甲与过量硫酸反应的产物为 (写化学式)。16g甲在空气中充分燃烧,生成一种常见液态物质和氮气,放出311kJ热量,则其热化学方程式为 。
(3)甲和丙反应的产物中含有乙和一种气态单质,写出其化学方程式 。
(4)向乙的固体中加入过量硫酸酸化的硫酸铁溶液,乙固体完全溶解,得到透明溶液。
①写出其离子方程式 。
②若所得溶液中阳离子浓度均约为0.1mol/L,再向所得混合溶液中加丙,最先得到 沉淀(不同浓度的阳离子开始和完全以氢氧化物沉淀的pH如下图)。

③向上述混合液中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)
 R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。请设计实验方案,验证有机相中含有铜元素。
R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。请设计实验方案,验证有机相中含有铜元素。Ⅰ.回答下列问题:
(1)欲量取20.00mL Na2CO3溶液,应选用的仪器是
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、
(3)在测定硫酸铜晶体中含量的实验中,称量操作至少要进行
Ⅱ.氢氧化铜是一种常用试剂.例如,利用新制氢氧化铜验证醛类物质的还原性.
(1)新制氢氧化铜悬浊液的配制,实验室制取氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2mL,滴入2%的硫酸铜溶液4~6滴,振荡即成.这样操作的目的是
下面是三个研究性学习小组分别从不同层面开展的研究性学习活动:
(2)研究性学习小组甲:对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜.为了确定红色沉淀的成分,开展了如下研究:提出猜想:
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应:③在空气中灼烧氧化亚铜生成氧化铜.
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为bg,比较a,b关系
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出.
你认为合理的方案是
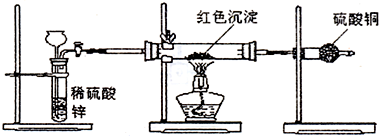
(3)研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示.你认为要测定上述红色沉淀成分必须测定下列哪些物理量(只填序号):
①通入氢气体积;②反应前,红色沉淀+硬质玻璃管的总质量;③完全反应后红色固体+硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量
(4)研究性学习小组丙上网查阅新闻得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”.绿色化学强调对环境友好,实现零排放.“变废为宝”符合绿色化学要求.他们收集上述红色沉淀制备化学试剂-蓝矾.请你帮助他们设计一个简单且符合绿色化学要求的实验方案:
查看习题详情和答案>>
(1)欲量取20.00mL Na2CO3溶液,应选用的仪器是
碱式滴定管
碱式滴定管
.(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、
环形玻璃搅拌棒
环形玻璃搅拌棒
、量筒
量筒
.(3)在测定硫酸铜晶体中含量的实验中,称量操作至少要进行
4
4
次.Ⅱ.氢氧化铜是一种常用试剂.例如,利用新制氢氧化铜验证醛类物质的还原性.
(1)新制氢氧化铜悬浊液的配制,实验室制取氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2mL,滴入2%的硫酸铜溶液4~6滴,振荡即成.这样操作的目的是
确保氢氧化钠过量,氢氧化铜呈悬浊状
确保氢氧化钠过量,氢氧化铜呈悬浊状
.下面是三个研究性学习小组分别从不同层面开展的研究性学习活动:
(2)研究性学习小组甲:对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜.为了确定红色沉淀的成分,开展了如下研究:提出猜想:
红色沉淀可能是铜或铜与氧化亚铜的混合物(或红色固体中可能含有铜)
红色沉淀可能是铜或铜与氧化亚铜的混合物(或红色固体中可能含有铜)
.查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应:③在空气中灼烧氧化亚铜生成氧化铜.
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为bg,比较a,b关系
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出.
你认为合理的方案是
方案3
方案3
.(3)研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示.你认为要测定上述红色沉淀成分必须测定下列哪些物理量(只填序号):
②③⑤
②③⑤
.①通入氢气体积;②反应前,红色沉淀+硬质玻璃管的总质量;③完全反应后红色固体+硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量
(4)研究性学习小组丙上网查阅新闻得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”.绿色化学强调对环境友好,实现零排放.“变废为宝”符合绿色化学要求.他们收集上述红色沉淀制备化学试剂-蓝矾.请你帮助他们设计一个简单且符合绿色化学要求的实验方案:
在空气中充分灼烧该红色固体至全部转化成氧化铜,加入足量稀硫酸溶解,蒸发、结晶、过滤、洗涤,用滤纸吸干或通入惰气带走水分
在空气中充分灼烧该红色固体至全部转化成氧化铜,加入足量稀硫酸溶解,蒸发、结晶、过滤、洗涤,用滤纸吸干或通入惰气带走水分
.
高中阶段常用化学反应方程式
- 钠在空气中燃烧(黄色的火焰)
- 钠与水反应(浮、熔、游、响、红)
- 过氧化钠与水的反应
- 过氧化钠与二氧化碳的反应
- 苏打(纯碱)与盐酸反应
- 小苏打受热分解
- *固体氢氧化钠、碳酸氢钠混合物在密闭容器中加热
- 金属锂在空气中燃烧
- 铜丝在氯气中剧烈燃烧(棕色烟)
- 铁在氯气中剧烈燃烧
- 氢气在氯气中燃烧(苍白色火焰,瓶口白雾)
- 氯气溶于水及新制氯水的成分:
- 次氯酸见光分解(强氧化剂、杀菌消毒、漂白剂)
- 工业制漂白粉原理
- 氯气实验室制法(主仪器:分液漏斗、圆底烧瓶等)
- 新制氯水注入盛溴化钠溶液的试管中
- 用电子式表示溴化镁、氯化氢分子的形成
- 铁与硫加热反应
- 硫化氢充分燃烧
- 硫化氢不完全燃烧
- 硫化亚铁与稀盐酸反应
- 二氧化硫制三氧化硫(无色固体,熔点16.8℃,44.8℃)
- 浓硫酸与铜反应
- 浓硫酸与非金属碳的反应
- 工业制单质硅(碳在高温下还原二氧化硅)
- 二氧化硅与氢氧化钠反应
- 氮气和氢气反应
- 氮气与氧气放电条件下反应
- 二氧化氮溶于水
- NO2、O2混合气通入水中无剩余气体
- 一定量的NO、O2混合通入水中无剩余气体
- 五氧化二磷与热水反应
- 磷在氯气中充分燃烧
- 氨的催化氧化
- 碳酸氢铵受热分解
- 用浓盐酸检验氨气(白烟生成)
- 硫酸铵溶液与氢氧化钠溶液混合加热
- 硝酸铵溶液与氢氧化钠溶液混合(不加热)
- 铝箔在氧气中剧烈燃烧
- 铝片与稀盐酸反应
- 铝与氢氧化钠溶液反应
- 铝与三氧化二铁高温下反应(铝热反应)
- 镁在二氧化碳中燃
- 氧化铝溶于氢氧化钠溶液
- 硫酸铝溶液中滴过量氨水
- 氢氧化铝溶液中加盐酸
- *高温下铁与水反应
- 铁与盐酸反应
- 氧化铁溶于盐酸中
- 化铁中滴入氢氧化钠溶液(红褐色沉淀)
- 氢氧化亚铁在空气中氧化
- 氯化亚铁溶液中通入氯气
- 氯化铁溶液中加入铁粉
- 甲烷与氯气取代生成四氯化碳
- 乙烯实验室制法(浓硫酸作催化剂,脱水剂)
- 乙烯通入溴水中
- 制取聚乙烯、聚丙烯
- 乙制取
- 由乙炔制聚乙烯
- 与液溴反应(需铁作催化剂)
- 苯的硝化反应
- 与氢气加成生成环己烷
- 甲苯发生硝化反应
- 乙烷水解
- 乙烷消去反应
- 醇与钠反应
- 乙醇催化氧化
- 苯酚与氢氧化钠溶液反应
- 苯酚钠溶液中通入二氧化碳
- 苯酚的定性检验定量测定方法:
- 醛制1-丙醇
- 醛制乙酸
- 乙醛的银镜反应
- 醛与新制氢氧化铜悬浊液
- *乙酸与氢氧化铜悬浊液
- 酸乙酯制取(用饱和碳酸钠溶液收集)
- 葡萄糖结构简式
- 蔗水解方程式
- 淀粉水解
- 硬脂酸甘油酯皂化反应