摘要:13.有机合成工业中原子利用率高.原料来源丰富.价格低廉且无污染.称其为“绿色化学 .以下反应中符合绿色化学原理的是 A.乙烯和氧气在银催化下生成环氧乙烷 B.乙烷与氯气制备一氯乙烷 C.60℃时.乙炔与H2O在硫酸汞酸性溶液中合成乙醛 D.乙醇与浓硫酸共热制备乙烯
网址:http://m.1010jiajiao.com/timu3_id_245637[举报]
有机合成工业中原子利用率高、原料来源丰富、价格低廉且无污染,称其为“绿色化学”.以下反应中符合绿色化学原理的是( )
查看习题详情和答案>>
A.乙烯与氧气在银催化下生成环氧乙烷 |
| B.乙烷与氯气制备一氯乙烷 |
| C.60℃时,乙炔与水在硫酸汞酸性溶液中合成乙醛 |
| D.乙醇与浓硫酸共热制备乙烯 |
有机合成工业中原子利用率高、原料来源丰富、价格低廉且无污染,称其为“绿色化学”.以下反应中符合绿色化学原理的是( )
A.乙烯与氧气在银催化下生成环氧乙烷
B.乙烷与氯气制备一氯乙烷
C.60℃时,乙炔与水在硫酸汞酸性溶液中合成乙醛
D.乙醇与浓硫酸共热制备乙烯
查看习题详情和答案>>
A.乙烯与氧气在银催化下生成环氧乙烷

B.乙烷与氯气制备一氯乙烷
C.60℃时,乙炔与水在硫酸汞酸性溶液中合成乙醛
D.乙醇与浓硫酸共热制备乙烯
查看习题详情和答案>>
工业合成氨与制备硝酸一般可连续生产,流程如下
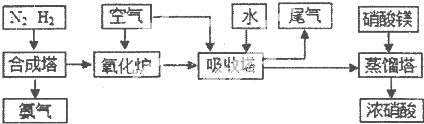
(1)①工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2,850℃时,往1L密闭容器中充入0.3mol CO和0.2molH2O(g).反应4min后建立平衡,体系中c(H2)=0.12mol?L-1.CO的平衡浓度为
②在850℃时,以表中的物质的量投入恒容反应器中,其中向逆反应方向进行的有
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率图1所示.温度高于900℃时,NH3产率下降,原因是
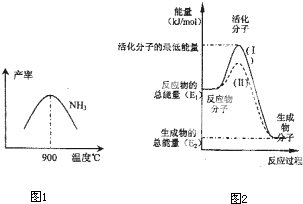
(4)在化学反应中只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图2,回答问题.
图中所示反应是
O2(g)=H2O(g)△H=-241.8kJ?mol-1,该反应的活化能为167.2kJ?mol-1,则其逆反应的活化能为
(5)硝酸厂的尾气直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
查看习题详情和答案>>

(1)①工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2,850℃时,往1L密闭容器中充入0.3mol CO和0.2molH2O(g).反应4min后建立平衡,体系中c(H2)=0.12mol?L-1.CO的平衡浓度为
0.18mol/L
0.18mol/L
转化率为40%
40%
该温度下此反应的平衡常数K=1
1
(填计算结果).②在850℃时,以表中的物质的量投入恒容反应器中,其中向逆反应方向进行的有
A
A
(选填A、B、C、D、E)| A | B | C | D | E | |
| n(CO2) | 3 | l | 0 | 1 | l |
| n(H2) | 2 | l | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | l |
<
<
300℃(填“>”、“<”或“=”).| T/°C | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
900℃时反应达到平衡状态,再升高温度平衡向左移动
900℃时反应达到平衡状态,再升高温度平衡向左移动
.
(4)在化学反应中只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图2,回答问题.
图中所示反应是
放热
放热
(填“吸热”或“放热”)反应,该反应的△H=-(E1-E2)kJ/mol
-(E1-E2)kJ/mol
(用含E1、E2E的代数式表示).已知热化学方程式:H2(g)+| 1 |
| 2 |
409kJ/mol
409kJ/mol
.(5)硝酸厂的尾气直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ?mol-1
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ?mol-1
.工业上制备BaCl2的工艺流程图如下:
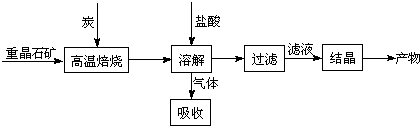
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s)
4CO(g)+BaS(s)△H1=571.2kJ?mol-1 ①
BaSO4(s)+2C(s)
2CO2(g)+BaS(s)△H2=226.2kJ?mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为
(2)反应C(s)+CO2(g)
2CO(g)的△H2=
(3)“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径.
①下列措施中,有利于降低大气中CO2浓度的有:
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
②将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O
C6H12O6 b.CO2+3H2
CH3OH+H2O
c.CO2+CH4
CH3COOH d.2CO2+6H2
CH2═CH2+4H2O
以上反应中,最节能的是
查看习题详情和答案>>

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s)
| 高温 |
BaSO4(s)+2C(s)
| 高温 |
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为
S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
. (2)反应C(s)+CO2(g)
| 高温 |
172.5
172.5
kJ?mol-1.(3)“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径.
①下列措施中,有利于降低大气中CO2浓度的有:
abcd
abcd
.(填字母)a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
②将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O
| 光合作用 |
| 催化剂 |
| △ |
c.CO2+CH4
| ||
| △ |
| ||
| △ |
以上反应中,最节能的是
a
a
,原子利用率最高的是c
c
.