摘要:12.下列各反应属于氧化反应的是 A.乙炔通入酸性KMnO4溶液.溶液褪色 B.乙烯通入溴水.溴水褪色 C.乙烯一定条件合成聚乙烯 D.苯在一定条件下与H2作用.生成环已烷
网址:http://m.1010jiajiao.com/timu3_id_245315[举报]
 甲、乙两池电极材料如图所示,请按要求回答下列问题:
甲、乙两池电极材料如图所示,请按要求回答下列问题:(1)若两池中均为Cu(NO3)2溶液,反应一段时间后:
①有红色物质析出的是甲池中的
碳
碳
棒(铁、碳);乙池中的阴
阴
极(阴、阳).②乙池中阳极上发生的电极反应方程式是
4OH--4e-═O2↑+2H2O
4OH--4e-═O2↑+2H2O
.(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式
2H2O+2NaCl
2NaOH+H2↑+Cl2↑
| ||
2H2O+2NaCl
2NaOH+H2↑+Cl2↑
.
| ||
②甲池中碳极上电极反应方程式是
O2+4e-+2H2O═4OH-
O2+4e-+2H2O═4OH-
,乙池碳极上电极反应属于氧化反应
氧化反应
(填氧化反应、还原反应).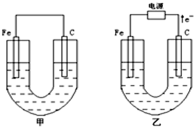 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:(1)若两池中均为CuSO4溶液,反应一段时间后
①有红色物质析出的是甲池中的
碳
碳
棒,乙池中的铁
铁
棒.②乙池中阳极的电极反应式是
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
.(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
②甲池中碳极上电极反应式是
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
,乙池碳极上电极反应属于氧化反应
氧化反应
(填氧化反应、还原反应).③若乙池转移0.02mole-后停止实验,溶液体积是200mL,则溶液混匀后的pH=
13
13
. 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的
碳
碳
棒,乙池中的铁
铁
棒.②乙池中阳极的电极反应式是
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
.(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
②甲池中碳极上电极反应式是
2H2O+O2+4e-=4OH-
2H2O+O2+4e-=4OH-
,乙池碳极上电极反应属于氧化反应
氧化反应
(填“氧化反应”或“还原反应”).③将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去.这是因为过量的Cl2将生成的I2又氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,该反应的化学方程式为
5Cl2+I2+6H2O=2HIO3+10HCl
5Cl2+I2+6H2O=2HIO3+10HCl
.④若乙池转移0.02mol e-后停止实验,池中溶液体积是200mL,测溶液混匀后的pH=
13
13
. 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的
碳
碳
棒,乙池中的铁
铁
棒.②乙池中阳极的电极反应式是
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
.(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
.
| ||
②甲池中碳极上电极反应式是
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
,乙池碳极上电极反应属于氧化反应
氧化反应
(填“氧化反应”或“还原反应”).③若乙池转移0.02mol e-后停止实验,池中溶液体积是200mL,则溶液混合均匀后的所得NaOH溶液的物质的量浓度为
0.1mol/L
0.1mol/L
. ),(俗称尼泊金乙酯)可用作防腐剂,对霉菌有很强的抑制作用.其过程如下:
),(俗称尼泊金乙酯)可用作防腐剂,对霉菌有很强的抑制作用.其过程如下:


 +HI
+HI