摘要:1. 从电解质电离程度掌握强电解质和弱电解质.
网址:http://m.1010jiajiao.com/timu3_id_244360[举报]
下列说法中,正确的是
[ ]
A.电离程度大的电解质就是强电解质
B.由于加水稀释时,弱电解质电离程度增大,故其溶液的导电能力也增强
C.10mL 0.1mol·L-1氨水与100mL 0.01mol·L-1氨水中,所含有OH-的个数不同
D.温度升高时,弱电解质的电离程度减小
查看习题详情和答案>>|
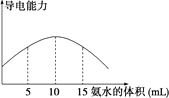
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如下图,则加入氨水前CH3COOH的电离度为
| |
| [ ] | |
A. |
0.5% |
B. |
1.5% |
C. |
0.1% |
D. |
1% |
|
下列说法错误的是 | |
| [ ] | |
A. |
NaHCO3是强电解质,其溶液中不存在溶质微粒的电离平衡 |
B. |
弱电解质电离程度随温度的升高而增大 |
C. |
弱电解质稀溶液再被稀释时,弱电解质电离程度增大,但离子浓度减小 |
D. |
弱电解质达到电离平衡时,溶质分子和离子的浓度保持不变 |
 (2012?济南一模)(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度.100℃时1mol?L-1 的NaOH溶液中,由水电离出的c(H+)=
(2012?济南一模)(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度.100℃时1mol?L-1 的NaOH溶液中,由水电离出的c(H+)=1×10-12
1×10-12
mol?L-1,KW(25℃)
<
<
KW(100℃)(填“>”、“<”或“=”之一).25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进
促进
(填“促进”“抑制”或“不影响”之一).(2)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |
Na2CO3溶液>NaCN溶液>CH3COONa溶液
Na2CO3溶液>NaCN溶液>CH3COONa溶液
.②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)
>
>
c(CH3COO-)(填“>”、“<”或“=”之一).③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:
NaCN+H2O+CO2=HCN+NaHCO3
NaCN+H2O+CO2=HCN+NaHCO3
.