网址:http://m.1010jiajiao.com/timu3_id_244210[举报]
(1)某碳酸氢钠样品中含有少量氯化钠.称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL.若改用0.05618mol/L硫酸滴定,需用硫酸
(2)某溶液组成如表一:
表一
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 814.8 | 400.3 | 97.3 |
表二
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 137.7 | 428.8 | 97.3 |
(3)将组成如表二的溶液加热,使碳酸氢纳部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸纳,使溶液组成回到表一状态.计算补加的碳酸纳质量(保留1位小数).
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103 L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg.通过计算确定该晶体的化学式.
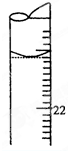 某氢氧化钾样品中含有少量不与酸作用的杂质,为了测定其质量分数,进行以下滴定操作:
某氢氧化钾样品中含有少量不与酸作用的杂质,为了测定其质量分数,进行以下滴定操作:A.在250ml的容量瓶中配制250ml的氢氧化钾溶液;
B.将氢氧化钾溶液装入碱式滴定管,调节液面,向锥形瓶中滴入25.00ml氢氧化钾溶液并滴入几滴甲基橙指示剂;
C.在天平上准确称取KOH样品Wg,在烧杯中用蒸馏水溶解;
D.将物质的量浓度为C mol/L的标准硫酸溶液装入酸式滴定管,调节液面记下开始读数为V1;
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2.就此完成下列填空:
(1)操作步骤的正确顺序是(用编号字母填)
(2)E步骤的操作中在锥形瓶下垫一张白纸的作用是
(3)上述B步骤操作之前,若锥形瓶用KOH样品洗涤,则测定的浓度
(4)D步骤的操作中液面应调节到
(5)若滴定结束时,滴定管液面如图所示,则终点读数为
碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
54.某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸 mL(保留两位小数)。
55.某溶液组成如表一:

问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:

计算析出的碳酸氢纳晶体的质量(保留1位小数)。
56.将组成如表二的溶液加热,使碳酸氢纳部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸纳,使溶液组成回到表一状态。计算补加的碳酸纳质量(保留1位小数)。
57.某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式。
查看习题详情和答案>>碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
(1)某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸 mL(保留两位小数)。
(2)某溶液组成如表一:
|
化合物 |
Na2CO3 |
NaHCO3 |
NaCl |
|
质量(kg) |
814.8 |
400.3 |
97.3 |
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:
|
化合物 |
Na2CO3 |
NaHCO3 |
NaCl |
|
质量(kg) |
137.7 |
428.8 |
97.3 |
计算析出的碳酸氢钠晶体的质量(保留1位小数)。
(3)将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留1位小数)。
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式
查看习题详情和答案>>
碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
(1)某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸 mL(保留两位小数)。
(2)某溶液组成如表一:
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 814.8 | 400.3 | 97.3 |
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 137.7 | 428.8 | 97.3 |
计算析出的碳酸氢钠晶体的质量(保留1位小数)。
(3)将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留1位小数)。
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式 查看习题详情和答案>>