摘要:(1)Cl2与金属反应.生成高价金属氯化物 2Na + Cl2 2NaCl 2Fe +3Cl2 2FeCl3 Cu + Cl2 CuCl2 (2)氯气的制法 Cl2的实验室制法 MnO2 +4 HCl(浓) MnCl2 +Cl2↑ + 2H2O
网址:http://m.1010jiajiao.com/timu3_id_243973[举报]
某些化学反应可用下式表示:A+B→C+D+H2O 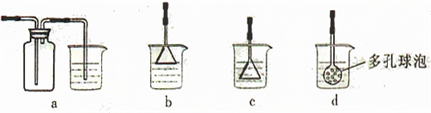
请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:
(2)若C为氯化钠,D能使澄清石灰水变浑浊的无味气体,则A与B的组合是:
(3)若A为红色金属单质,B为第二周期某种元素的最高价氧化物的水化物,
(Ⅰ)当C为无色气体时,相应的化学方程式为
(Ⅱ)当C为红棕色气体时,氧化剂与还原剂的物质的量之比为
(4)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是
(5)当C为可以使湿润的红色石蕊试纸变蓝的气体时,实验室进行该气体的尾气处理,应选用下列
查看习题详情和答案>>

请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(2)若C为氯化钠,D能使澄清石灰水变浑浊的无味气体,则A与B的组合是:
盐酸和碳酸钠、盐酸和碳酸氢钠
盐酸和碳酸钠、盐酸和碳酸氢钠
.(3)若A为红色金属单质,B为第二周期某种元素的最高价氧化物的水化物,
(Ⅰ)当C为无色气体时,相应的化学方程式为
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
.(Ⅱ)当C为红棕色气体时,氧化剂与还原剂的物质的量之比为
2:1
2:1
,每生成标准状况下11.2L的该气体,转移电子的数目约为3.01×1023
3.01×1023
.(4)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是
碳和浓硫酸
碳和浓硫酸
.(5)当C为可以使湿润的红色石蕊试纸变蓝的气体时,实验室进行该气体的尾气处理,应选用下列
b
b
装置(填序号)能说明硫的非金属性比氯元素弱的主要事实是
①氯气可溶于水,而硫难溶于水
②硫最高价态为+6,而氯最高价态为+7
③铁与氯气化合生成FeCl3,铁与硫粉化合生成FeS
④H2与S化合需要加热至300℃以上,H2与Cl2化合点燃即可以反应
- A.①②
- B.②③
- C.③④
- D.②④
表中原子化热、晶格能、键能的单位都是kJ·mol-1
|
金属 |
金属原子化热 |
离子化合物 |
晶格能 |
共价键 |
键能 |
|
Na |
108.4 |
NaCl |
786 |
Cl-Cl |
243 |
|
Mg |
146.4 |
NaBr |
747 |
Si-Si |
176 |
|
Al |
326.4 |
MgO |
3791 |
Si-Cl |
360 |
则下列说法正确的是( )
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H=-602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
查看习题详情和答案>>
表中原子化热、晶格能、键能的单位都是kJ·mol-1
|
金属 |
金属原子化热 |
离子化合物 |
晶格能 |
共价键 |
键能 |
|
Na |
108.4 |
NaCl |
786 |
Cl-Cl |
243 |
|
Mg |
146.4 |
NaBr |
747 |
Si-Si |
176 |
|
Al |
326.4 |
MgO |
3791 |
Si-Cl |
360 |
则下列说法正确的是( )
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H=-602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
查看习题详情和答案>>
表中原子化热、晶格能、键能的单位都是kJ·mol-1
| 金属 | 金属原子化热 | 离子化合物 | 晶格能 | 共价键 | 键能 |
| Na | 108.4 | NaCl | 786 | Cl-Cl | 243 |
| Mg | 146.4 | NaBr | 747 | Si-Si | 176 |
| Al | 326.4 | MgO | 3791 | Si-Cl | 360 |
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H= - 602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强 查看习题详情和答案>>