摘要:A.B.C.D.E的名称分别是:乙炔.乙烯.丁炔.甲烷.乙烷,其他答案略
网址:http://m.1010jiajiao.com/timu3_id_243756[举报]
A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族.A、C能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1.B元素基态原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素.根据以上信息回答下列问题:
(1)D元素的名称为
(2)C、D、F的简单离子中,半径最小的是
(3)BA4的空间构型为
(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为
(5)下列关于甲和乙的说法中,错误的是
①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零.
查看习题详情和答案>>
(1)D元素的名称为
氟
氟
,E的电子排布式为ls22s22p63s1
ls22s22p63s1
;(2)C、D、F的简单离子中,半径最小的是
Al3+
Al3+
(填离子符号);(3)BA4的空间构型为
正四面体
正四面体
,B、C两元素形成的非极性分子的结构式为O=C=O
O=C=O
;(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
,可以相互反应生成O2的化学方程式为2Na2O2+CO2═2Na2CO3+O2
2Na2O2+CO2═2Na2CO3+O2
;(5)下列关于甲和乙的说法中,错误的是
①③⑤
①③⑤
(填序号)①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零.
A、B、C、D、E五种短周期元素的原子序数依次增大,上述元素中只有一种金属元素.A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体.又已知C、E的单质均可溶于NaOH溶液,且C与NaOH溶液反应可产生气体.
(1)写出D、E五种元素的名称:A.
(2)写出AB2 的电子式: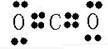
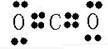
(3)写出DB2使澄清石灰水变浑浊的化学方程式:
(4)写出C、E的单质分别与NaOH溶液反应的离子方程式:
查看习题详情和答案>>
(1)写出D、E五种元素的名称:A.
碳
碳
B.氧
氧
C.铝
铝
D.硫
硫
,E.氯
氯
.(2)写出AB2 的电子式:
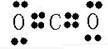
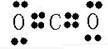
(3)写出DB2使澄清石灰水变浑浊的化学方程式:
SO2+Ca(OH)2═CaSO3↓+H2O
SO2+Ca(OH)2═CaSO3↓+H2O
.(4)写出C、E的单质分别与NaOH溶液反应的离子方程式:
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
,Cl2+2OH-═ClO-+Cl-+H2O
Cl2+2OH-═ClO-+Cl-+H2O
.A、B、C、D、E分别代表五种短周期元素,且原子序数依次增大,已知:B的最外层电子排布是nsnnpn+1;C的p能级上未成对的电子比B少一个;D的二价阳离子与C的阴离子具有相同的电子层结构;E与D同周期且E在该周期中原子半径最小;B与A的单质能生成具有刺激性气味的气体,该气体极易溶于水.
(1)B原子核外电子排布式为
(2)A与E化合时原子间以
(3)写出A、C的单质直接化合形成的化合物与E单质反应的离子方程式:
(4)A与B形成化合物时,中心原子采取
(5)将白色的无水CuSO4溶解于A2C中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式:
(6)五种元素中电负性最大的是
查看习题详情和答案>>
(1)B原子核外电子排布式为
1s22s22p3
1s22s22p3
.(2)A与E化合时原子间以
共价
共价
键相结合,D与C化合时原子间以离子
离子
键相结合.(3)写出A、C的单质直接化合形成的化合物与E单质反应的离子方程式:
Cl2+H2O═H++Cl-+HClO
Cl2+H2O═H++Cl-+HClO
.(4)A与B形成化合物时,中心原子采取
sp3
sp3
杂化成键,其立体结构为三角锥形
三角锥形
,属于极性
极性
(填“极性”或“非极性”)分子.(5)将白色的无水CuSO4溶解于A2C中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式:
Cu2++4H2O=[Cu(H2O)4]2+
Cu2++4H2O=[Cu(H2O)4]2+
.(6)五种元素中电负性最大的是
氧
氧
(填元素名称).A、B、C、D、E为5种短周期元素,且原子序数依次增大.A的原子半径最小;B的电子总数与其最外层电子数之比为3:2;C的最高价氧化物对应水化物与其简单氢化物反应生成一种盐类物质甲.A、E同主族,A、B、C、E都能分别与D形成原子个数比不同的常见化合物.请回答下列问题:
(1)B在周期表中位于第 族,甲的名称是 .
(2)A、C两元素按原子数目比3:1和2:1构成分子M和N,N的电子式为 .在微电子工业中,M的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为 .
(3)由C、E组成的化合物乙是汽车安全气囊中的一种成分.现取13.0g乙,加热使其完全分解,生成一种气体单质(标准状况下的体积为6.72L)和一种固体单质,则乙的化学式是 .
(4)近年来太原市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.汽车内燃机工作时引起反应:C2(g)+D2(g)?2CD(g),是导致汽车尾气中含有CD的原因之一.T℃时,向容积为2L的密闭容器中充入10molC2与5molD2,达到平衡后CD的物质的量为2mol,则T℃时该反应的平衡常数K= (计算结果保留两位有效数字).在其他条件不变的情况下,再通入10molC2与5moD2,达到平衡常数时C2的转化率将 (填“增大”、“减小”或“不变”,下同),CD的平衡浓度将 .
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染.
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=CO2(g)+2H2O(g)+2N2(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ?mol-1
△H2= .
查看习题详情和答案>>
(1)B在周期表中位于第
(2)A、C两元素按原子数目比3:1和2:1构成分子M和N,N的电子式为
(3)由C、E组成的化合物乙是汽车安全气囊中的一种成分.现取13.0g乙,加热使其完全分解,生成一种气体单质(标准状况下的体积为6.72L)和一种固体单质,则乙的化学式是
(4)近年来太原市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.汽车内燃机工作时引起反应:C2(g)+D2(g)?2CD(g),是导致汽车尾气中含有CD的原因之一.T℃时,向容积为2L的密闭容器中充入10molC2与5molD2,达到平衡后CD的物质的量为2mol,则T℃时该反应的平衡常数K=
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染.
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=CO2(g)+2H2O(g)+2N2(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ?mol-1
△H2=