摘要: 已知:2Fe2++Br2=2Fe3++2Br-.2I-+2Fe3+=2Fe2++I2 试回答下列问题: (1)试比较Fe2+.I-.Br-的还原性强弱. (2)少量Cl2通入FeBr2溶液中.写出反应的离子方程式. (3)过量Cl2通入FeBr2溶液中.写出反应的离子方程式.
网址:http://m.1010jiajiao.com/timu3_id_243567[举报]
(2010?西城区模拟)如图所示反应I、反应II和反应III均是工业生产中常见的反应.其中A、B为化合物,C是温室气体之一,D和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应III和E与G反应的原理相同.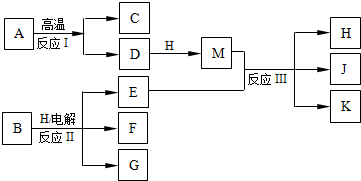
(1)C的电子式是
 .
.
(2)反应II的离子方程式是
(3)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是
(4)工业上测定反应III产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果.
①用Na2S2O3标准溶液滴定I2时选用的指示剂是
②生成I2的反应的离子方程式是
(5)已知:2Fe2++Br2=2Fe3++2Br-.若将0.1mol E通入100mL FeBr2溶液中,溶液中有三分之一的Br-被氧化成Br2,则此反应离子方程式是
查看习题详情和答案>>

(1)C的电子式是


(2)反应II的离子方程式是
2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
.
| ||
(3)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是
Ca(ClO)2═CaCl2+O2↑
Ca(ClO)2═CaCl2+O2↑
.(4)工业上测定反应III产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果.
①用Na2S2O3标准溶液滴定I2时选用的指示剂是
淀粉
淀粉
.②生成I2的反应的离子方程式是
ClO-+2I-+2H+=Cl-+I2+H2O
ClO-+2I-+2H+=Cl-+I2+H2O
.(5)已知:2Fe2++Br2=2Fe3++2Br-.若将0.1mol E通入100mL FeBr2溶液中,溶液中有三分之一的Br-被氧化成Br2,则此反应离子方程式是
6Fe2++4Br-+5Cl25Cl2-═6Fe3++2Br2+10Cl-
6Fe2++4Br-+5Cl25Cl2-═6Fe3++2Br2+10Cl-
,原FeBr2溶液的物质的量浓度为1.2 mol/L
1.2 mol/L
.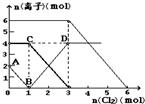 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-;2Fe3++2I-=2Fe2++I2.则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-;2Fe3++2I-=2Fe2++I2.则下列有关说法中,不正确的是( )
查看习题详情和答案>>
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2.则下列说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2.则下列说法中不正确的是( )
查看习题详情和答案>>
 (2010?济南一模)向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
(2010?济南一模)向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
查看习题详情和答案>>
已知Br2+2Fe2+=2Fe3++2Br-,当向含1molFeBr2洛液中逐渐通入Cl2,溶液中有一半的Br-氧化时,下列判断不正确的是( )
| A、反应前后溶液的颜色发生了改变 | B、反应后溶液中c(Cl-)=C(Br-) | C、参加反应的Cl2为1 mol | D、反应的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |