网址:http://m.1010jiajiao.com/timu3_id_243059[举报]
下列有关金属的说法正确的是( )
A.用坩埚钳夹住铁丝在酒精灯上加热红热,迅速伸进氧气瓶中,燃烧火星四射,放出大量的热,生成红棕色的固体
B.钠可以与冷水反应生成碱和氢气,铁必须与水蒸气反应才能生成碱和氢气。
C.相同物质的量的钠在常温和加热的条件下与氧气反应所得的产物不同,但转移的电子数相同
D.等物质的量的铝分别与足量的盐酸和NaOH溶液反应,生成相同条件下氢气的体积比为1:3
查看习题详情和答案>>(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是____________;X与过量浓硝酸反应后溶液中含有的盐的化学式
为____________。
(2)某溶液中有Mg2+、Fe2+、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是
____________;
A.Mg2+ B.Fe2+ C.A13+ D.Cu2+
(3)氧化铁是重要工业颜料,用废秩屑制备它的流程如下
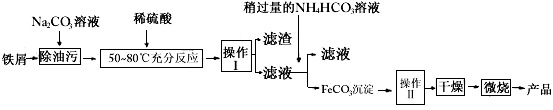
①操作I的名称是____________,操作II的名称是____________;操作III的方法为____________。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)________________________;
③请完成生成FeCO3沉淀的离子方程式________________________。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+==5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需____________。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是____________。
A.稀硝酸 B.稀盐酸 C.稀硫酸 D.浓硝酸
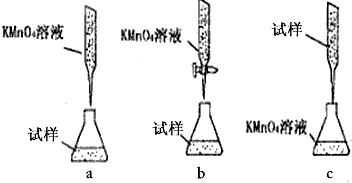
③某同学设计的下列滴定方式,最合理的是____________。(夹持部分略去)(填字母序号)

①操作I的名称是_______,操作II的名称是________;操作Ⅱ的方法为_____________
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)____________________;
③请完成生成FeCO3沉淀的离子方程式__________________
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+ = 5Fe3++Mn2+ +4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________________。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是_________
A.稀硝酸 B.稀盐酸 C.稀硫酸 D.浓硝酸
③某同学设计的下列滴定方式,最合理的是_______。 (夹持部分略去)(填字母序号)

钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。
(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子排布式为_______,铝元素的原子结构示意图为_________。
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是_____________(用离子符号表示)。在短周期中非金属性最强的元素位于第____周期____族。
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律。下列有关说法正确的是___________(选填编号)。
a.三种元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加![]()
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性。第三周期主族元素的电负性如下:
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
从上表可以看出电负性的大小与元素非金属性的强弱关系是____________________;大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律,AlBr3中的化学键类型应该是 。
查看习题详情和答案>>(8分)钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。
(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子排布式为_______,铝元素的原子结构示意图为_________。
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是_____________(用离子符号表示)。在短周期中非金属性最强的元素位于第____周期____族。
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律。下列有关说法正确的是___________(选填编号)。
a.三种元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性。第三周期主族元素的电负性如下:
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |