摘要:用0.2136mol/L盐酸测定未知浓度的KOH溶液.实验数据如下表所示.计算KOH的物质的量浓度. 实验编号 待测KOH溶液的体积/ml 滴入0.2136mol/L盐酸的体积/ml 1 25.00 23.32 2 25.00 23.30 3 25.00 23.28 2006学年 第一学期 台州市路桥区新桥中学 高二期中评估试题
网址:http://m.1010jiajiao.com/timu3_id_242747[举报]
碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等.工业上用纯碱溶液碳酸化制取碳酸氢钠.
(1)某碳酸氢钠样品中含有少量氯化钠.称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL.若改用0.05618mol/L硫酸滴定,需用硫酸 mL(保留两位小数).
(2)某溶液组成如表一:
表一
向该溶液通入二氧化碳,析出碳酸氢钠晶体.取出晶体后溶液组成如表二:
表二
计算析出的碳酸氢纳晶体的质量(保留1位小数).
(3)将组成如表二的溶液加热,使碳酸氢纳部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸纳,使溶液组成回到表一状态.计算补加的碳酸纳质量(保留1位小数).
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103 L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg.通过计算确定该晶体的化学式.
查看习题详情和答案>>
(1)某碳酸氢钠样品中含有少量氯化钠.称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL.若改用0.05618mol/L硫酸滴定,需用硫酸
(2)某溶液组成如表一:
表一
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 814.8 | 400.3 | 97.3 |
表二
| 化合物 | Na2CO3 | NaHCO3 | NaCl |
| 质量(kg) | 137.7 | 428.8 | 97.3 |
(3)将组成如表二的溶液加热,使碳酸氢纳部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸纳,使溶液组成回到表一状态.计算补加的碳酸纳质量(保留1位小数).
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103 L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg.通过计算确定该晶体的化学式.
用中和滴定法测定烧碱的纯度,若烧碱中含有少量不与酸作用的可溶性杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品.
(2)将样品配成250mL待测液,需要的仪器有小烧杯、玻璃棒、
(3)用
(4)用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,滴定时
(5)若两次实验滴定的数据如下表:
根据上表数据,计算待测烧碱溶液的浓度:
(6)根据上述各数据,计算烧碱的纯度:
(7)滴定时,滴定管尖嘴部分滴定前有气泡,滴定终了无气泡,测定结果将
查看习题详情和答案>>
(1)准确称取4.1g烧碱样品.
(2)将样品配成250mL待测液,需要的仪器有小烧杯、玻璃棒、
250mL容量瓶
250mL容量瓶
、胶头滴管.(3)用
碱式滴定管
碱式滴定管
量取10mL待测液于锥形瓶
锥形瓶
中(填仪器名称),并滴加几滴甲基橙作指示剂.(4)用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,滴定时
左
左
手旋转酸
酸
式滴定管的玻璃活塞,右
右
手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点,滴定终点时锥形瓶内溶液的PH约为3.1~4.4
3.1~4.4
,达到终点的具体现象是:溶液由黄色变为橙色,且半分钟不变色
溶液由黄色变为橙色,且半分钟不变色
.(5)若两次实验滴定的数据如下表:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.4 |
| 第二次 | 10.00 | 4.00 | 24.1 |
0.4020 mol?L-1
0.4020 mol?L-1
.(6)根据上述各数据,计算烧碱的纯度:
98.05%
98.05%
(7)滴定时,滴定管尖嘴部分滴定前有气泡,滴定终了无气泡,测定结果将
偏高
偏高
(填偏高、偏低或无影响,其它操作均正确).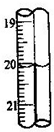 (2012?长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(2012?长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:(1)查资料得该晶体在110℃可完全失去结晶水.于是将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;恒温在110℃一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误:
加热后没有在干燥器中冷却
加热后没有在干燥器中冷却
,晶体加热后,没有进行恒重操作
晶体加热后,没有进行恒重操作
.(2)已知2KMnO4+5H2C2O4+3H2SO4→K2SO4+10CO2↑+2MnSO4+8H2O,现称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液,取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳.向反应后的溶液中加入一小匙锌粉,加热至浅黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.加入锌粉的目的是
将Fe3+还原成Fe2+,为进一步测定铁元素的含量做准备
将Fe3+还原成Fe2+,为进一步测定铁元素的含量做准备
.(3)用0.010mol/L KMnO4溶液滴定上一步骤所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-被还原成Mn2+.写出发生反应的离子方程式
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
.(4)上述实验滴定时,指示剂应该
不加
不加
(填“加”或“不加”),如何判断滴定终点:当待测液中出现紫红色,且振荡后半分钟内不再褪色,就表明到了终点
当待测液中出现紫红色,且振荡后半分钟内不再褪色,就表明到了终点
.(5)在(2)题步骤中,若加入的KMnO4的溶液的量不足,可导致测得的铁含量
偏高
偏高
.(选填“偏低”“偏高”“不变”)(6)重复(2)(3)步骤操作,滴定消耗0.010mol/L KMnO4溶液19.98ml.则实验测得该晶体中铁的质量分数为
11.12%
11.12%
.若蓝色手柄滴定管滴定后读数如右图所示,则以下记录的数据正确的是A
A
A.20.00mL B.20.0mL C.20.10mL D.20.1mL.
(2011?南京二模)废铁屑为原料生产莫尔盐的主要流程如下: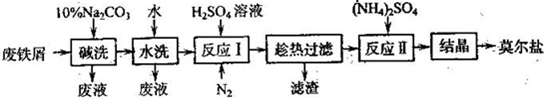
(1)“反应I”中通入N2的作用是
(2)称取23.52g新制莫尔盐,溶于水配制成100mL溶液,将所得溶分成两等份.一份加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体13.98g.另一份用0.2000mol?L-1 K2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为25.00mL.通过计算确定莫尔盐的化学式-
(3)若将“水洗”这一步去掉,则所得产品中SO42-的质量分数会
查看习题详情和答案>>

(1)“反应I”中通入N2的作用是
防止Fe2+被氧化为Fe3+,且起搅拌作用,以加快反应速率
防止Fe2+被氧化为Fe3+,且起搅拌作用,以加快反应速率
.(2)称取23.52g新制莫尔盐,溶于水配制成100mL溶液,将所得溶分成两等份.一份加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体13.98g.另一份用0.2000mol?L-1 K2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为25.00mL.通过计算确定莫尔盐的化学式-
(3)若将“水洗”这一步去掉,则所得产品中SO42-的质量分数会
偏小
偏小
(填“偏大”、“偏小”或“不变”).
三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]?3H2O)有很重要的用途.可用如下流程来制备.根据题意完成下列各题:
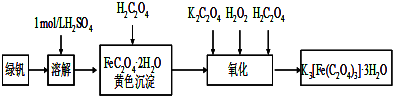
(1)若用铁和稀硫酸制备绿矾(FeSO4?7H2O)过程中,其中 (填物质名称)往往要过量,理由是 .
(2)要从溶液中得到绿矾,必须进行的实验操作是 .(按前后顺序填)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤3:在酸性条件下,用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00ml,滴定中MnO4-,被还原成Mn2+.
(3)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;主要操作步骤依次是:称量、溶解、转移、 、定容、摇匀.
(4)步骤2中,加入锌粉的目的是 .
(5)步骤3中,发生反应的离子方程式为: .
(6)步骤2中,若加入的KMnO4的溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”、“不变”)
查看习题详情和答案>>

(1)若用铁和稀硫酸制备绿矾(FeSO4?7H2O)过程中,其中
(2)要从溶液中得到绿矾,必须进行的实验操作是
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤3:在酸性条件下,用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00ml,滴定中MnO4-,被还原成Mn2+.
(3)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有
(4)步骤2中,加入锌粉的目的是
(5)步骤3中,发生反应的离子方程式为:
(6)步骤2中,若加入的KMnO4的溶液的量不够,则测得的铁含量