摘要:⑴10体积,⑵77.8%,⑶0.44mol, ⑷0<x≤5/9.y=0,5/9<x<2/3.y=3ax-5/3a,x≥2/3.a-ax.
网址:http://m.1010jiajiao.com/timu3_id_241373[举报]
(2009?广州二模)乙酸乙酯是重要的化工原料,沸点约77℃.其水解反应方程式为CH3COOC2H5+H2O?CH3COOH+C2H5OH酸和碱均可用作该反应的催化剂.某兴趣小组对NaOH溶液催化乙酸乙酯水解进行了探究.
实验步骤:
向试管中加入8mLNaOH溶液,再加入2mL乙酸乙酯,用直尺量出乙酸乙酯的高度.再把试管放入70℃的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度.再迅速放回水浴中继续加热,如此反复进行.改变NaOH溶液浓度,重复实验.
数据记录:
乙酸乙酯水解后剩余的高度/min
回答下列问题:
(1)完成上述对比实验时,每组实验都必须控制不变的因素有
(2)分析上述数据,得到乙酸乙酯水解速率的结论是:
①NaOH溶液浓度越大,水解速率越
(3)结论②的理论解释是
(4)欲使乙酸乙酯完全水解,可采取的措施是
(5)有同学认为有必要用蒸馏水代替NaOH溶液重复试验,对数据进行修正,主要原因是
查看习题详情和答案>>
实验步骤:
向试管中加入8mLNaOH溶液,再加入2mL乙酸乙酯,用直尺量出乙酸乙酯的高度.再把试管放入70℃的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度.再迅速放回水浴中继续加热,如此反复进行.改变NaOH溶液浓度,重复实验.
数据记录:
乙酸乙酯水解后剩余的高度/min
| 组别 | C(NaOH)/mol?L-1 | 时间/min | ||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 1 | 0.5 | 10.0 | 9.0 | 8.0 | 7.5 | 7.0 | 6.5 | 6.5 | 6.5 | 6.5 |
| 2 | 1.0 | 10.0 | 8.5 | 7.0 | 6.0 | 5.0 | 4.5 | 4.5 | 4.5 | 4.5 |
| 3 | 2.0 | 10.0 | 8.0 | 6.0 | 4.5 | 3.0 | 2.0 | 1.5 | 1.5 | 1.5 |
(1)完成上述对比实验时,每组实验都必须控制不变的因素有
NaOH溶液的体积乙酸乙酯的用量
NaOH溶液的体积乙酸乙酯的用量
、反应温度
反应温度
.(2)分析上述数据,得到乙酸乙酯水解速率的结论是:
①NaOH溶液浓度越大,水解速率越
快
快
②乙酸乙酯水解速率先快后慢,一段时间后停止水解
乙酸乙酯水解速率先快后慢,一段时间后停止水解
.(3)结论②的理论解释是
NaOH能与水解产物醋酸发生中和反应,随着反应的进行,NaOH浓度逐渐减小直到完全消耗,其催化作用也逐渐减弱直到没有催化作用
NaOH能与水解产物醋酸发生中和反应,随着反应的进行,NaOH浓度逐渐减小直到完全消耗,其催化作用也逐渐减弱直到没有催化作用
.(4)欲使乙酸乙酯完全水解,可采取的措施是
增大NaOH的浓度(或体积)
增大NaOH的浓度(或体积)
.(5)有同学认为有必要用蒸馏水代替NaOH溶液重复试验,对数据进行修正,主要原因是
乙酸乙酯水解过程中部分挥发
乙酸乙酯水解过程中部分挥发
.定量分析中可用AgNO3溶液滴定Cl-溶液,加入K2CrO4为指示剂,达到滴定终点时溶液体积为50mL,c(Cl-) = 10-5 mol·L-1,AgNO3与CrO42- 生成砖红色的Ag2CrO4沉淀。已知Ksp(AgCl) = 1.77×10-10, Ksp(AgI) = 8.51×10-17,Ksp(Ag2CrO4) = 1.12×10-12,根据以上实验操作和有关数据,下列说法正确的是
A.常温下,向含AgCl固体的AgCl溶液中加入NaCl固体,AgCl沉淀的量不变
B.滴定终点时,溶液中CrO42-的浓度约为3.6×10-3 mol·L-1
C.向10mL0.1moL/L AgNO3溶液中滴加3—5滴0.1moL/L NaCl溶液生成AgCl沉淀,再滴加KI溶液,生成AgI沉淀,能够说明Ksp(AgI)< Ksp(AgCl)
D.可用0.1 mol·L-1的KI溶液代替K2CrO4做指示剂
查看习题详情和答案>>
定量分析中可用AgNO3溶液滴定Cl-溶液,加入K2CrO4为指示剂,达到滴定终点时溶液体积为50mL,c(Cl-) = 10-5 mol·L-1,AgNO3与CrO42- 生成砖红色的Ag2CrO4沉淀。已知Ksp(AgCl) = 1.77×10-10,Ksp(AgI) = 8.51×10-17,Ksp(Ag2CrO4) = 1.12×10-12,根据以上实验操作和有关数据,下列说法正确的是
| A.常温下,向含AgCl固体的AgCl溶液中加入NaCl固体,AgCl沉淀的量不变 |
| B.滴定终点时,溶液中CrO42-的浓度约为3.6×10-3 mol·L-1 |
| C.向10mL0.1moL/L AgNO3溶液中滴加3—5滴0.1moL/L NaCl溶液生成AgCl沉淀,再滴加KI溶液,生成AgI沉淀,能够说明Ksp(AgI)< Ksp(AgCl) |
| D.可用0.1 mol·L-1的KI溶液代替K2CrO4做指示剂 |
定量分析中可用AgNO3溶液滴定Cl-溶液,加入K2CrO4为指示剂,达到滴定终点时溶液体积为50mL,c(Cl-) = 10-5 mol·L-1,AgNO3与CrO42- 生成砖红色的Ag2CrO4沉淀。已知Ksp(AgCl) = 1.77×10-10,Ksp(AgI) = 8.51×10-17,Ksp(Ag2CrO4) = 1.12×10-12,根据以上实验操作和有关数据,下列说法正确的是
- A.常温下,向含AgCl固体的AgCl溶液中加入NaCl固体,AgCl沉淀的量不变
- B.滴定终点时,溶液中CrO42-的浓度约为3.6×10-3 mol·L-1
- C.向10mL0.1moL/L AgNO3溶液中滴加3—5滴0.1moL/L NaCl溶液生成AgCl沉淀,再滴加KI溶液,生成AgI沉淀,能够说明Ksp(AgI)< Ksp(AgCl)
- D.可用0.1 mol·L-1的KI溶液代替K2CrO4做指示剂
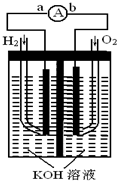 (2009?天津)氢氧燃料电池是符合绿色化学理念的新型发电装置.
(2009?天津)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是
由化学能转变为电能
由化学能转变为电能
,在导线中电子流动方向为由a到b
由a到b
(用a、b 表示).(2)负极反应式为
2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
.(3)电极表面镀铂粉的原因
增大电极单位面积吸附H2、O2分子数,加快电极反应速率
增大电极单位面积吸附H2、O2分子数,加快电极反应速率
.(4)该电池工作时,H2和O2连续由外部供给,电池可连续
不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
| ||
Ⅱ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是
Li
Li
,反应Ⅱ中的氧化剂是H2O
H2O
.②已知LiH固体密度约为0.8g/cm3.用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为
8.82×10-4
8.82×10-4
.③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
32
32
mol.