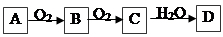摘要:1.1金属与非金属的反应
网址:http://m.1010jiajiao.com/timu3_id_239217[举报]
非金属单质A,经如下图所示的过程转化为含氧酸D,已知D为常见强酸

请回答下列问题:(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体①D的化学式是
②在工业生产中B气体的大量排放被雨水吸收后形成了
(2)若A在常温下为气体,C是红棕色气体
①A和C的化学式分别是:A
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
查看习题详情和答案>>

请回答下列问题:(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体①D的化学式是
H2SO4
H2SO4
②在工业生产中B气体的大量排放被雨水吸收后形成了
酸雨
酸雨
而污染了环境(2)若A在常温下为气体,C是红棕色气体
①A和C的化学式分别是:A
N2
N2
CNO2
NO2
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
. 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.(1)对反应N2O4(g)?2NO2(g),△H=+57kJ?mol-1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.
下列说法正确的是
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
(2)在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②已知100℃反应2NO2?N2O4的平衡常数K=2.8.若该温度下某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正
③若在相同情况下最初向该容器只充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是
④计算在题③的条件下达到平衡后混合气体的平均相对分子质量为
(3)肼(N2H4)通常是航天航空的重要燃料,我们常用的一种肼燃料电池,是以肼与氧气的反应为原理设计的(N2H4+O2=N2+2H2O),其电解质溶液是KOH溶液.写出该电池负极的电极反应式
非金属单质A,经如下图所示的过程转化为含氧酸D,已知D为常见强酸

请回答下列问题:
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体
①D的化学式是
②在工业生产中B气体的大量排放被雨水吸收后形成了 而污染了环境
(2)若A在常温下为气体,C是红棕色气体。①A和C的化学式分别是:A ;C
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
查看习题详情和答案>>
(6分)非金属单质A经下图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题
|
|
|

(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体
①D的化学式是 。
②在工业生产中,大量排放的B气体被雨水吸收后形成 而污染环境
(2)若A在常温下为气体,C是红棕色气体。
①A、C的化学式分别是 ; 。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
。
该反应 (填属于或不属于)氧化还原反应。
查看习题详情和答案>>