摘要:以直观表抽象.以比较辨是非. 对于本章学习难度较大的一些概念.要结合一些比喻和直观教具.尽量将抽象的概念形象化.以帮助理解和记忆.对于容易混淆的概念.要通过对比.找出它们之间的区别与联系.
网址:http://m.1010jiajiao.com/timu3_id_238025[举报]
三氯化铁在印刷、照像、医药、颜料以及有机合成催化剂方面有重要的应用。三氯化铁易潮解,在100℃时发生升华。通常,工业生产氯化铁有多种方法;其中一种常温氯化法是将氯气直接通入浸泡铁屑的水中来生成FeCl3。
请回答下列问题:
(1)完成常温氯化法制氯化铁过程中的化学反应方程式_____________(至少写出两个反应)。
(2)现对制备氯化铁的工艺进行改进,以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料。其生产流程如图:
请回答下列问题:
(1)完成常温氯化法制氯化铁过程中的化学反应方程式_____________(至少写出两个反应)。
(2)现对制备氯化铁的工艺进行改进,以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料。其生产流程如图:
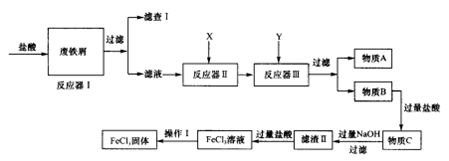
已知:氢氧化物沉淀过程中的pH:
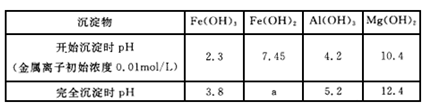
KSPFe(OH)2=1×10-15
①X最好加入_________,写出相应的离子反应方程式_______________
A.KMnO4 B.FeCl3 C.H2O2 D.HNO3
②加入试剂Y的目的是调节pH的范围,试剂Y是____________。上表中a=__________。
(3)改进后的方法与前一种方法比较优点是_______________。
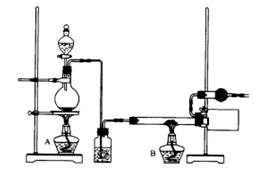
(4)实验室可以用下图所示装置制取无水三氯化铁。在实验开始时,A、B两个酒精应先点燃一会儿的是____________(填A或B),该装置应如何改进__________。
①X最好加入_________,写出相应的离子反应方程式_______________
A.KMnO4 B.FeCl3 C.H2O2 D.HNO3
②加入试剂Y的目的是调节pH的范围,试剂Y是____________。上表中a=__________。
(3)改进后的方法与前一种方法比较优点是_______________。
(4)实验室可以用下图所示装置制取无水三氯化铁。在实验开始时,A、B两个酒精应先点燃一会儿的是____________(填A或B),该装置应如何改进__________。
下面是某加碘食盐包装袋上的部分图表文字(I为碘元素符号).由此你得到的信息和作出的推测是( ) 配料表
|
查看习题详情和答案>>
(2010?南开区一模)乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
(1)写出该反应的平衡常数表达式:K=
.
(2)请说明以CO2为原料合成乙醇的优点是
(3)在一定压强下,测得该反应的实验数据如下表:
①该反应是
②一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率
(4)在下图的坐标系中作图说明压强变化对该反应化学平衡的影响,并对图中横坐标、纵坐标的含义作必要的标注.
(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧化碳.该电池的负极反应式为:
(6)25℃、101kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ?mol-1、1411.0kJ?mol-1和1366.8kJ?mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式
查看习题详情和答案>>
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
(1)写出该反应的平衡常数表达式:K=
| c(CH3OH)c3(H2O) |
| c2(CO2)c6(H2) |
| c(CH3OH)c3(H2O) |
| c2(CO2)c6(H2) |
(2)请说明以CO2为原料合成乙醇的优点是
废弃物利用,有利于环保
废弃物利用,有利于环保
(只要求写出一条).(3)在一定压强下,测得该反应的实验数据如下表:
| 温度/℃CO2转化率/% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
放热
放热
反应(填“吸热”或“放热”).②一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率
增大
增大
;平衡常数K不变
不变
.(填“增大”、“减小”、或“不变”)(4)在下图的坐标系中作图说明压强变化对该反应化学平衡的影响,并对图中横坐标、纵坐标的含义作必要的标注.

(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧化碳.该电池的负极反应式为:
C2H5OH-12e-+3H2O=2CO2+12H+
C2H5OH-12e-+3H2O=2CO2+12H+
.(6)25℃、101kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ?mol-1、1411.0kJ?mol-1和1366.8kJ?mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式
C2H4(g)+H2O(l)═C2H5OH(l);△H=-44.2 kJ/mol-1
C2H4(g)+H2O(l)═C2H5OH(l);△H=-44.2 kJ/mol-1
.研制和开发不含碳并可工业生产的清洁能源,一直是科学家不懈追求的目标,目前液氨被人们视为一种潜在的清洁燃料.液氨燃烧的化学反应方程式为:4NH3+3O2→2N2+6H2O.和氢燃料相比有关数据见下表,据此判断正确的是( )
②氨泄漏到空气中比氢气更易发生爆炸 ③等质量的氨和氢分别燃烧,氢放出的热量少 ④氮的液化比氢容易得多. |
查看习题详情和答案>>
(2012?武汉模拟)碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平)
(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式:
(2)步骤②中,用硝酸而不用HI,其原因可能是
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为
(4)参照下表碘酸钾的溶解度,步骤 得到碘酸钾晶体,你建议的方法是
得到碘酸钾晶体,你建议的方法是
(5)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液.总反应方程式为KI+3H2O=KIO3+3H2↑,则阳极的电极反应式为:
查看习题详情和答案>>

(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2
.若有1mol I2完全反应,则该反应中转移电子的数目为10NA
10NA
(设NA表示阿伏加德罗常数)(2)步骤②中,用硝酸而不用HI,其原因可能是
HI具有还原性,能将已生成的碘酸氢钾还原
HI具有还原性,能将已生成的碘酸氢钾还原
.(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为
Cl2能将KIO3氧化成KIO4
Cl2能将KIO3氧化成KIO4
.(4)参照下表碘酸钾的溶解度,步骤
 得到碘酸钾晶体,你建议的方法是
得到碘酸钾晶体,你建议的方法是蒸发结晶
蒸发结晶
.| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
I-+6OH--6e-=IO3-+2H2O
I-+6OH--6e-=IO3-+2H2O
.