网址:http://m.1010jiajiao.com/timu3_id_237947[举报]
I、高铁酸钾制备方法之一为:①在一定温度下,将氯气通入KOH溶液中制得次氯酸钾溶液;②在剧烈搅拌条件下,将Fe(NO3)3分批加入次氯酸钾溶液中,控制反应温度,以免次氯酸钾分解;③加 KOH至饱和,使K2FeO4 充分析出,再经纯化得产品,其纯度在95%以上.
(1)氯碱工业中制备氯气的化学方程式是
(2)温度过高会导致次氯酸钾分解生成两种化合物,产物之一是氯酸钾(KClO3),另一种产物应该是
(3)制备过程有一步反应如下,请配平此方程式(将计量数填入方框中):
| O | 2- 4 |
Ⅱ、为探究高铁酸钾的某种性质,进行如下两个实验:
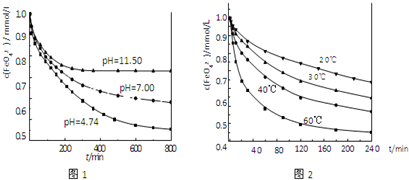
实验1:将适量K2FeO4分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0mmol?L-1(1mmol?L-1=10-3mol?L-1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800min后,三种溶液中高铁酸钾的浓度不再改变).
实验2:将适量 K2FeO4 溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0mmol?L-1 的试样,将试样分别置于 20℃、30℃、40℃和 60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2.
(4)实验1的目的是
(5)实验2可得出的结论是
(6)高铁酸钾在水中的反应为4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.
由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
Ⅲ、高铁酸钾还是高能电池的电极材料.例如,Al-K2FeO4电池就是一种高能电池(以氢氧化钾溶液为电解质溶液),该电池放电时负极反应式是
高铁酸钾(K2FeO4)具有极强的氧化性,因该物质具有“绿色”、选择性高、活性强等特点受到人们关注。
(1)高锰酸钾制备方法之一为:
①在一定温度下,将氯气通入KOH溶液中制得含有次氯酸钾的溶液;
②在剧烈搅拌条件下,将Fe(NO3)3分批加入次氯酸钾溶液中,控制反应温度,以免次氯酸钾分解;
③甲KOH至饱和,使K2FeO4充分析出,再经纯化得产品,其纯度在95%以上。
①氯碱工业中制备氯气的化学方程式是 ;
②温度过高会导致次氯酸钾自身分解生成两种化合物,产物之一是氯酸钾(KclO3),另一种产物应该是 (写化学式)。
③制备过程有一步反应如下,请配平方程式(将计量数填入方框中):
![]()
(2)为探究高铁酸钾的某种性质,进行如下两种实验:
实验一:将适量K2FeO4分别溶解于pH为4.74、7.00、11.50的水溶液中,配的FeO42―浓度为1.0m mol?L―1(1 m molL―1=1×103 mol?L―1)的试样,分别静置800min,考查初始pH不同的水溶液对K2FeO4某种性质的影响,结果见图1。
实验二:将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42―浓度为1.0m mol?L―1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,考查不同温度对K2FeO4某种性质的影响,结果见图2。
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为:FeO42―+10H2O![]() 4Fe(OH)3+8OH―+3O2↑
4Fe(OH)3+8OH―+3O2↑
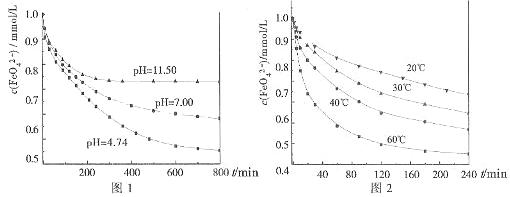
由图1可知,800min时,初始pH=11.50的溶液中,高铁酸钾的最终浓度比pH=4.74的溶液中高,主要原因是 。
查看习题详情和答案>>
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.(12分)2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主。砷化镓的品胞结构如右图。试回答:
(1)镓的基态原子的电子排布式是 。
(2)砷化镓品胞中所包含的砷原子(白色球)个数为 ,与同一个镓原子相连的砷原子构成的空 间构型为 。
间构型为 。
(3)下列说法正确的是 (填字母)。
A.砷化镓品胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
E.GaP与GaAs互为等电子体
(4)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是 。
(5)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为 。
B.(12分)乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②部分有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.5 | 78.5 | 117.9 | 77 |
(1)浓硫酸的作用是 ,球形干燥管的作用是 。
(2)用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为 、
等。

(3)实验所得到的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,除去 ;再进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | 同一反应应温度 | ||||
反应温度/ ℃ ℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物全部是乙酸乙酯和水 | |||||
a.120℃,4h b.80℃,2h c.60℃,4h d.40℃,3h
②当反应温度达到120℃时,反应选抒性降低的原因可能为 。 查看习题详情和答案>>
A.(12分)2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主。砷化镓的品胞结构如右图。试回答:

(1)镓的基态原子的电子排布式是 。
(2)砷化镓品胞中所包含的砷原子(白色球)个数为 ,与同一个镓原子相连的砷原子构成的空
 间构型为 。
间构型为 。(3)下列说法正确的是 (填字母)。
A.砷化镓品胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
E.GaP与GaAs互为等电子体
(4)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是 。
(5)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为 。
B.(12分)乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH
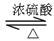 CH3COOC2H5+H2O
CH3COOC2H5+H2O已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②部分有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.5 | 78.5 | 117.9 | 77 |
(1)浓硫酸的作用是 ,球形干燥管的作用是 。
(2)用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为 、
等。

(3)实验所得到的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,除去 ;再进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | 同一反应应温度 | ||||
反应温度/ ℃ ℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物全部是乙酸乙酯和水 | |||||
a.120℃,4h b.80℃,2h c.60℃,4h d.40℃,3h
②当反应温度达到120℃时,反应选抒性降低的原因可能为 。
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.(12分)2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主。砷化镓的品胞结构如右图。试回答:
(1)镓的基态原子的电子排布式是 。
(2)砷化镓品胞中所包含的砷原子(白色球)个数为 ,与同一个镓原子相连的砷原子构成的空间构型为 。
(3)下列说法正确的是 (填字母)。
A.砷化镓品胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
E.GaP与GaAs互为等电子体
(4)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是 。
(5)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为 。
B.(12分)乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OHCH3COOC2H5+H2O
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②部分有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.5 | 78.5 | 117.9 | 77 |
请回答下列问题:
(1)浓硫酸的作用是 ,球形干燥管的作用是 。
(2)用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为 、
等。
(3)实验所得到的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,除去 ;再进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | 同一反应应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物全部是乙酸乙酯和水 |
①根据表中数据,下列 (填字母)为该反应的最佳条件。
a.120℃,4h b.80℃,2h c.60℃,4h d.40℃,3h
②当反应温度达到120℃时,反应选抒性降低的原因可能为 。
查看习题详情和答案>>