摘要:16.4P P4,△H =+17kJ·mol-1.根据以上方程式.下列推论正确 的是: A.当lmol白磷转变成红磷时放出17kJ热量 B.当4g红磷转变成白磷时吸收17kJ热量 C.正反应是一个放热反应 D.白磷热稳定性比红磷小
网址:http://m.1010jiajiao.com/timu3_id_236872[举报]
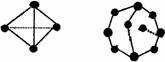
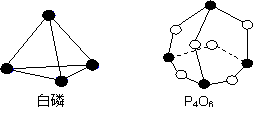
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放出(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示;现提供以下化学键的键能(kJ·mol-1)P—P:198;P—O:360;O=O:498,则反应P4(白磷)+3O2 = P4O6的反应热ΔH为( )
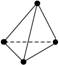

白磷 P4O6
A.-1638 kJ·mol-1 B.-126 kJ·mol-1
C.+1638 kJ·mol-1 D.+126 kJ·mol-1
查看习题详情和答案>>|
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如图所示:现提供以下化学键的键能(kJ·mol-1)P—P 198 P—O 360 O—O 498则反应P4(白磷)+3O2→P4O6的反应热△H为
| |
| [ ] | |
A. |
-1638kJ/mol |
B. |
+1638kJ/mol |
C. |
-126kJ/mol |
D. |
+126kJ/mol |
已知常温时红磷比白磷稳定,在下列反应中
4P(白磷,s)+5O2(g)==2P2O5(s);△H=-a kJ/mol
4P(红磷,s)+5O2(g)==2P2O5(s);△H=-b kJ/mol
若a、b均大于零,则a和b的关系为 ( )
A.a<b B.a=b C.a>b D.无法确定
查看习题详情和答案>>