摘要:7.下列化学反应中水作氧化剂的是 A.SO2+H2O B.Fe+H2O C.Cl2+H2O D.NO2+H2O
网址:http://m.1010jiajiao.com/timu3_id_235969[举报]
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.期中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子.
回答下列问题:
(1)C与D形成的化合物的化学式是
(2)将X气体通入A与F形成的化合物的水溶液中,使之恰好完全反应.此时溶液呈
(3)F的单质在反应中常作
(4)写出X分子的等电子体(原子数和电子数均相等的粒子)
 (用电子式表示),并写出该等电子体与X溶液反应的离子方程式:
(用电子式表示),并写出该等电子体与X溶液反应的离子方程式:
查看习题详情和答案>>
回答下列问题:
(1)C与D形成的化合物的化学式是
Al2O3
Al2O3
,它的性质决定了它在物质的分类中应属于两性氧化物
两性氧化物
;该化合物的水化物的电离方程式是H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
. Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-(2)将X气体通入A与F形成的化合物的水溶液中,使之恰好完全反应.此时溶液呈
酸
酸
性,(填“酸”、“碱”、中”);溶液中离子浓度由大到小的顺序为Cl->NH4+>H+>OH-
Cl->NH4+>H+>OH-
.(3)F的单质在反应中常作
氧化剂
氧化剂
剂,该单质的水溶液与E的低价氧化物反应的化学方程式是Cl2+SO2+2H2O═2HCl+H2SO4
Cl2+SO2+2H2O═2HCl+H2SO4
.(4)写出X分子的等电子体(原子数和电子数均相等的粒子)


NH3?H2O+H3O+═2H2O+NH4+
NH3?H2O+H3O+═2H2O+NH4+
. 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.A.[物质结构]
[Cu(NH3)4]SO4?H2O是一种杀虫剂.
(1)Cu元素基态原子的电子排布式为
(2)元素N、O、S的第一电离能由大到小排列的顺序为
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为
(5)与S
| O | 2- 4 |
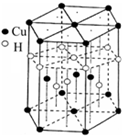
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为
B.[实验化学]
目前市场上大量矿泉水、食用油等产品包装瓶几乎都是用PET(聚对苯二甲酸乙二醇酯,简称聚酯)制作的.利用废聚酯饮料瓶制备对苯二甲酸的反应原理如下:
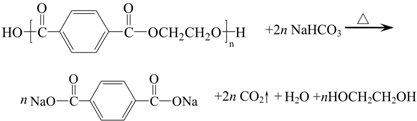
实验过程如下:
步骤1:在100mL四颈瓶上分别装置冷凝管、搅拌器和温度计.依次加入5g废饮料瓶碎片、0.05g氧化锌、5g碳酸氢钠和25mL乙二醇.缓慢搅拌,油浴加热,升温至180℃,反应15分钟.
步骤2:冷却至160℃停止搅拌,将搅拌回流装置改成搅拌、减压蒸馏装置,减压蒸馏.
步骤3:向四颈瓶中加入50mL沸水,搅拌使残留物溶解.抽滤除去少量不溶物.
步骤4:将滤液转移到400mL烧杯中,用25mL水荡洗滤瓶并倒入烧杯中,再添加水使溶液总体积达200mL,加入沸石,将烧杯置于石棉网上加热煮沸.
步骤5:取下烧杯,取出沸石后趁热边搅拌边用8~10mL 1:1HCl酸化,酸化结束,体系呈白色浆糊状.
步骤6:冷至室温后再用冰水冷却.抽滤,滤饼用蒸馏水洗涤数次至滤出液pH=6,抽干后再用10mL丙酮分2次洗涤,抽干,干燥.
(1)步骤1反应过程中的现象是
(2)步骤2是为了分离出
(3)步骤3抽滤需要用到的主要仪器有
(4)步骤4加沸石的目的是
(5)步骤5用盐酸酸化的目的是
(6)步骤6用丙酮洗涤的目的是