网址:http://m.1010jiajiao.com/timu3_id_233472[举报]
A.有些活泼金属如铝可作热还原法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收废旧金属,可以重新制得金属或它们的化合物
查看习题详情和答案>>|
下列说法中,正确的是 | |
A. |
有些活泼金属如铝可作热还原法的还原剂 |
B. |
用电解NaCl溶液的方法来冶炼金属钠 |
C. |
可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 |
D. |
回收废旧金属,可以重新制得金属或它们的化合物 |
(09盐城第三次调研)一些较活泼的金属在某些特定的介质环境中,会变为惰性状态,这是由于金属表面上覆盖了一层氧化膜。铁在不同浓度的硝酸中溶解与钝化情况如图如示。试探究下列问题:
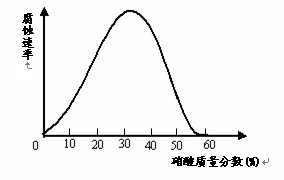
(1)现有一枚光亮的铁钉,欲使其表面形成钝化层,应将其放入浓度大于 的硝酸中一段时间;证明其表面已形成一层致密的钝化层的简单实验是: 。
(2)下列有关说法不正确的是 (选填序号)。
![]()
A.铜难溶于冷的浓硫酸,是因为铜在浓硫酸中发生钝化
B.铜片和铝片用导线连接后插入冷的浓硝酸中,电流一定总是由铜电极沿导线流入铝极
C.铁在硝酸溶液中的腐蚀速率与硝酸浓度一定呈正比
D.可用冷的浓硝酸除去铝制容器内的水垢
(3)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:3Fe+NaNO2+5NaOH![]() 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;
8Fe+3NaNO3+5NaOH+2H2O![]() 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;
以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平: 。
(4)为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应: 。
查看习题详情和答案>> 研究金属的冶炼对人类有重要意义.
研究金属的冶炼对人类有重要意义.(1)人类历史上大量生产和使用铝、铁、钛、铜四种金属单质的时间顺序是
(2)铜的冶炼中有一步是2CuFeS2+4O2=Cu2S+3SO2+2FeO,反应的氧化产物是
(3)如图是部分金属氧化物被一氧化碳还原时lg[p(CO)/p(CO2)]与温度的关系曲线图.则四种金属氧化物中最易被还原的金属氧化物是,该反应的△H
(4)下列说法正确是
A.氧化镁跟铝粉共热适于炼镁
B.不锈钢含有金属和非金属元素
C.所有金属均以化合物存在于自然界
D.金属冶炼中还原剂可以是一些活泼金属
E.活泼金属的冶炼都是通过电解其盐溶液制得
F.金属提炼一般要经过矿石的富集、冶炼、精炼三步
(5)为测定某一铁矿石样品中的铁元素的质量分数,取3.702g该铁矿石(铁以Fe2O3形式存在,其余物质不含铁)溶于浓热盐酸中,稀释至250mL,从中取出25mL溶液,作如下处理:加入过量的氨水,使铁以氢氧化铁的形式沉淀,将沉淀过滤,洗净并灼烧,使之完全转化为氧化铁.有关实验数据:坩埚质量:15.2861g,三次灼烧后坩埚和固体的质量:15.6209g、15.6205g、15.6205g.则铁矿石中的铁元素的质量分数为
(11分)研究金属的冶炼对人类有重要意义。
(1)人类历史上大量生产和使用铝、铁、钛、铜四种金属单质的时间顺序是____________。
(2)铜的冶炼中有一步是2CuFeS2+4O2=Cu2S+3SO2+2FeO,反应的氧化产物是 。
 (3)右图是部分金属氧化物被一氧化碳还原时lg[p(CO)/p(CO2)]与温度的关系曲线图。则四种金属氧化物中最易被还原的金属氧化物是 ,该反应的△H 0。
(3)右图是部分金属氧化物被一氧化碳还原时lg[p(CO)/p(CO2)]与温度的关系曲线图。则四种金属氧化物中最易被还原的金属氧化物是 ,该反应的△H 0。
(4)下列说法正确是
A.氧化镁跟铝粉共热适于炼镁
B.不锈钢含有金属和非金属元素
C.所有金属均以化合物存在于自然界
D.金属冶炼中还原剂可以是一些活泼金属
E.活泼金属的冶炼都是通过电解其盐溶液制得
F.金属提炼一般要经过矿石的富集、冶炼、精炼三步
(5)为测定某一铁矿石样品中的铁元素的质量分数, 取3.702g该铁矿石(铁以Fe2O3形式存在,其余物质不含铁)溶于浓热盐酸中,稀释至250mL,从中取出25mL溶液,作如下处理:加入过量的氨水,使铁以氢氧化铁的形式沉淀,将沉淀过滤,洗净并灼烧,使之完全转化为氧化铁。有关实验数据:坩埚质量:15.2861g,三次灼烧后坩埚和固体的质量:15.6209g、15.6205g、15.6205g 。则铁矿石中的铁元素的质量分数为__________________(百分数中的数字保留到小数点后一位)。
查看习题详情和答案>>