网址:http://m.1010jiajiao.com/timu3_id_233425[举报]
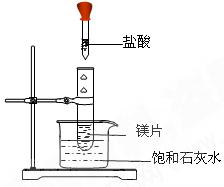
如右图所示,把试管放入盛有25 ℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
(1)实验中观察到的现象是___________________。
(2)产生上述现象的原因是____ __。
(3)写出有关反应的离子方程式:____________ _。
(4)由实验推知,MgCl2溶液和H2的总能量______(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
查看习题详情和答案>>
如右图所示,把试管放入盛有25 ℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中。试回答下列问题:
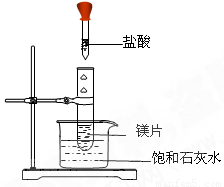
(1)实验中观察到的现象是___________________。
(2)产生上述现象的原因是____ __。
(3)写出有关反应的离子方程式:____________ _。
(4)由实验推知,MgCl2溶液和H2的总能量______(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
查看习题详情和答案>>
如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
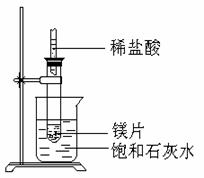 ①实验中观察到的现象是
①实验中观察到的现象是
。
②产生该现象的原因
③写出有关反应的离子反应方程式
④由此推知,MgCl2溶液和H2的总能量 填(“大于”“小于”或“等于”)镁片和盐酸的总能量
查看习题详情和答案>>