摘要:由3517Cl原子组成的氯气7.7g.(1)其中的电子总数为 .(2)与此电子个数相同的3717C1原子的质量为 g.(3)其中的中子总数为
网址:http://m.1010jiajiao.com/timu3_id_233191[举报]
如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.
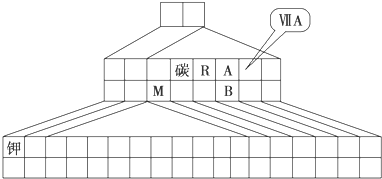
回答下列问题:
(1)请在图中将过渡元素所在的位置涂黑.
(2)M的氧化物含有的化学键为 ,工业上用于冶炼M的化学方程式为 .
(3)M和R组成化合物MR的超细粉末被广泛应用于大规模集成电路生产等领域.其制取原理是用M的氧化物、R的单质与碳单质在高温下反应,已知反应中三种物质的物质的量之比为1:1:3,该反应的化学方程式为 ,反应中 作氧化剂.
(4)图中A、B两元素形成的离子B2A
中,B元素呈现最高价,B原子位于由A原子组
成的四面体的中心,且所有原子的最外层电子均满足8电子结构.该离子可能具有的化学性质是 ,依据是 .
查看习题详情和答案>>

回答下列问题:
(1)请在图中将过渡元素所在的位置涂黑.
(2)M的氧化物含有的化学键为
(3)M和R组成化合物MR的超细粉末被广泛应用于大规模集成电路生产等领域.其制取原理是用M的氧化物、R的单质与碳单质在高温下反应,已知反应中三种物质的物质的量之比为1:1:3,该反应的化学方程式为
(4)图中A、B两元素形成的离子B2A
2- 8 |
成的四面体的中心,且所有原子的最外层电子均满足8电子结构.该离子可能具有的化学性质是
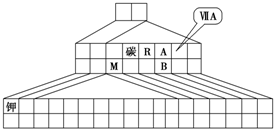 如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.
如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.回答下列问题:
(1)请在图中将过渡元素所在的位置涂黑.
(2)工业上用于冶炼M的化学方程式为
2Al2O3
4Al+3O2
| ||
2Al2O3
4Al+3O2
.
| ||
(3)M和R组成化合物MR的超细粉末被广泛应用于大规模集成电路生产等领域.其制取原理是用M的氧化物、R的单质与碳单质在高温下反应,已知反应中三种物质的物质的量之比为1:1:3,该反应的化学方程式为
Al2O3+N2+3C
2AlN+3CO
| ||
Al2O3+N2+3C
2AlN+3CO
,反应中
| ||
N2
N2
作氧化剂.(4)图中A、B两元素形成的离子B2A8-2中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.该离子可能具有的化学性质是
氧化性
氧化性
,依据是离子结构中存在-O-O-(部分氧元素呈-1价亦可)
离子结构中存在-O-O-(部分氧元素呈-1价亦可)
.《物质结构与性质》
均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6.A和C分子中的原子个数比为1:1,B和D分子中的原子个数比为1:2.D可作为火箭推进剂的燃料.请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为 (用元素符号回答).
(2)A与HF相比,其熔、沸点较低,原因是 .
(3)B分子的空间构型为 形,该分子属于 分子.(填“极性”或“非极性”)
(4)C为一种绿色氧化剂,有广泛应用.请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式 ,该反应中反应物Cu原子的基态电子排布式为 .铜晶体中铜原子的堆积方式为面心立方堆积,如图是铜晶体一个晶胞的示意图,则晶胞中含 个铜原子.
(5)D分子中心原子的杂化方式是 ,由该原子组成的单质分子中包含
个π键,与该单质分子互为等电子体的常见分子的分子式为 .
查看习题详情和答案>>
均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6.A和C分子中的原子个数比为1:1,B和D分子中的原子个数比为1:2.D可作为火箭推进剂的燃料.请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为
(2)A与HF相比,其熔、沸点较低,原因是
(3)B分子的空间构型为

(4)C为一种绿色氧化剂,有广泛应用.请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式
(5)D分子中心原子的杂化方式是
 2SO3的说法中正确的是( )
2SO3的说法中正确的是( ) 2SO3是生产过程中的重要反应.下列对于该反应的说法中正确的是( )
2SO3是生产过程中的重要反应.下列对于该反应的说法中正确的是( )