摘要:6.把两个用导线联接的铁电极放入到没有空气的溶液中.当在其中一个电极上通入氧气则发现另一个电极开始溶解.且导线上有电流通过.而通氧气的电极周围的溶液变成了碱性.试解释这一现象.写出电极反应式.画出电池图并标出阴极.阳极及电子流动的方向.
网址:http://m.1010jiajiao.com/timu3_id_232899[举报]
如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。试依次写出Fe电极上可能发生的电极反应式:____________、___________(可不填满,也可补充)
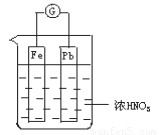
查看习题详情和答案>>
如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。试依次写出Fe电极上可能发生的电极反应式:____________、___________(可不填满,也可补充)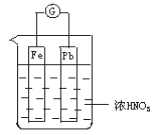
如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。试写出可能的电极反应式,并指出正、负电极及电极反应类型。
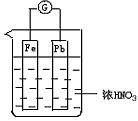
(1)Fe:____________、___________(可不填满,也可补充,下同);
(2)Pb片:__________、____________。
查看习题详情和答案>>
(2)Pb片:__________、____________。
|
如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余.下列说法正确的是
| |
A. |
Fe比Pb活泼,始终作负极 |
B. |
Fe在浓硝酸中钝化,始终不会溶解 |
C. |
电池停止工作时,烧杯中生成了硝酸铁 |
D. |
利用浓硝酸做电解质溶液不符合“绿色化学”思想 |
下列实验操作能达到实验目的是( )
|
查看习题详情和答案>>
