网址:http://m.1010jiajiao.com/timu3_id_232415[举报]
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
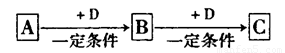
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学程式为______________。
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的化学式为 ___________________.
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)___________________。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为________________。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根离子外还存在的阴离子为___________ (填化学式)。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为____________________________.
(7)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成。则A生成B的化学方程式是_________________。
查看习题详情和答案>>
| +D |
| 一定条件 |
| +D |
| 一定条件 |
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体.则A转化为B反应的化学方程式为______.
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的电子式为______.
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)______.
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子.则B转化为C的离子方程式为______.
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为______.
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为______.
(7)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成.则A生成B的化学方程式为______.
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学程式为______________。
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的化学式为 ___________________.
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)___________________。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为________________。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根离子外还存在的阴离子为___________ (填化学式)。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为____________________________.
(7)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成。则A生成B的化学方程式是_________________。
查看习题详情和答案>>
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |


(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族.下列有关说法正确的是
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料.抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料.有关化合物QX的制备及化学性质如下(所有热量数据均已折合为25℃、101.3kPa条件下的数值)
①可用Q和X的单质在800~1000℃制得,每生成1mol QX,吸收a kJ的热量.
②可用Q的氧化物、焦炭和X的单质在1600~1750℃生成QX,每生成1mol QX,消耗18g碳,吸收b kJ的热量.
请根据上述信息写出在理论上Q的氧化物跟焦炭反应生成Q单质和CO的热化学方程式
(4)X、Y组成的一种无色气体遇空气变为红棕色.将标准状况下40L该无色气体与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式
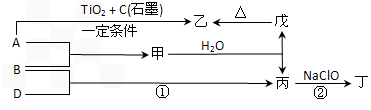
(1)单质A的组成元素在周期表中的位置是________________。
(2)乙中所包含的化学键类型有_____________(填字母序号)。
a.离子键 b. 极性共价键 c.非极性共价键
(3)用电子式表示丙分子的形成过程______________。
(4)反应①的化学方程式为____________。
(5) 丁的电子式为____________。
(6)反应②中,0.5 mol NaClO参加反应时,转移1mol 电子,其离子方程式为:_____________。
(7)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为 ______________。