摘要:19.可逆反应2SO2 + O2 2SO3在一定条件下达到化学反应的限度时( ) ① 消耗2 mol SO2的同时生成2 mol SO3 ② SO2.O2与SO3的物质的量之比为2∶1∶2 ③ 反应混合物中.SO3的质量分数不再改变 A.①② B.①③ C.只有③ D.只有①
网址:http://m.1010jiajiao.com/timu3_id_231754[举报]
可逆反应2SO2 + O2 ![]() 2SO3在一定条件下达到化学反应的限度时( )
2SO3在一定条件下达到化学反应的限度时( )
① 消耗2 mol SO2的同时生成2 mol SO3 ② SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
A.①② B.①③ C.只有③ D.只有①
查看习题详情和答案>>可逆反应2SO2 + O2 2SO3在一定条件下达到化学反应的限度时( )
2SO3在一定条件下达到化学反应的限度时( )
① 消耗2 mol SO2的同时生成2 mol SO3 ② SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
 2SO3在一定条件下达到化学反应的限度时( )
2SO3在一定条件下达到化学反应的限度时( )① 消耗2 mol SO2的同时生成2 mol SO3 ② SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
可逆反应2SO2 + O2 ![]() 2SO3在一定条件下达到化学反应的限度时( )
2SO3在一定条件下达到化学反应的限度时( )
![]() ① 消耗2 mol SO2的同时生成2 mol SO3 ② SO2、O2与SO3的物质的2∶1∶2
① 消耗2 mol SO2的同时生成2 mol SO3 ② SO2、O2与SO3的物质的2∶1∶2
![]() ③ 反应混合物中,SO3的质量分数不再改变
③ 反应混合物中,SO3的质量分数不再改变
![]() A.①② B.①③ C.只有③ D.只有①
A.①② B.①③ C.只有③ D.只有①
 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0(1)写出该反应的化学平衡常数表达式K=
| c2(SO3) |
| c2(SO2)c(O2) |
| c2(SO3) |
| c2(SO2)c(O2) |
增大
增大
,二氧化硫转化率增大
增大
,V正减小
减小
,V逆减小
减小
.(填“增大”“减小”或“不变”)
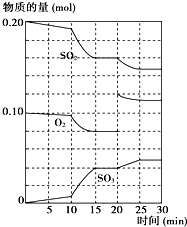
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是
15-20min、25-30min
15-20min、25-30min
.(3)据右图判断,反应进行至20min时,曲线发生变化的原因是
增大氧气的浓度
增大氧气的浓度
(用文字表达);10min到15min的曲线变化的原因可能是ab
ab
(填写编号).a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)已知在600℃时,2SO2(g)+O2(g)?2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态?
否
否
(填“是”或“否”).此时,化学反应速率是v(正)>
>
v(逆)(填“>”、“<”或“=”),原因是反应向正方向进行
反应向正方向进行
. 2SO3(g).下列说法中,表明这一反应已经达到化学平衡状态的是( )
2SO3(g).下列说法中,表明这一反应已经达到化学平衡状态的是( )