网址:http://m.1010jiajiao.com/timu3_id_231025[举报]
粗盐提纯的研究.
【有关资料】
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 4.96×10-9 | 4.96×10-9 | 2.34×10-9 | 5.61×10-12 |
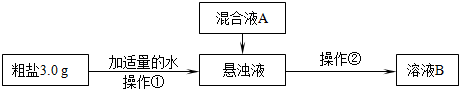
【设计除杂过程】
(1)操作①中需要使用的玻璃仪器有______、______.操作②的名称为______,若在操作②结束后发现溶液B略有浑浊,应采取的措施是______.
(2)混合液A的主要成分是______.(填化学式)
【检验除杂效果】
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽.向其中一支试管中加入______溶液(填化学式),看是否有沉淀生成.
步骤二:检验Ca2+是否除尽.向另一支试管中加入某溶液,看是否有沉淀生成.效果最好的是______(填字母).
A、Na2CO3 B、Na2SO3 C、Na2C2O4
【获取纯净食盐】
(4)对溶液B加热并不断滴加6mol?L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.该操作的目的是______.
(5)将溶液C倒入______(填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到______时(填现象),停止加热.
【问题讨论】
(6)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,目的是______,该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在______以下. 查看习题详情和答案>>
粗盐提纯的研究。
![]() 【有关资料】
【有关资料】
化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
Ksp | 4.96×10―9 | 4.96×10―9 | 2.34×10―9 | 5.61×10―12 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42―的存在),该小组设计流程如下:
![]()

【设计除杂过程】
![]()
![]()
(1)操作①中需要使用的玻璃仪器有 、 。操作②的名称为 ,若在操作②结束后发现溶液B略有浑浊,应采取的措施是_ _____________________________________________________。
(2)混合液A的主要成分是____________________。(填化学式)
【检验除杂效果】
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是 (填字母)。
A、Na2CO3 B、Na2SO
【获取纯净食盐】
(4)对溶液B加热并不断滴加6 mol?L―1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 ![]() ___________ _____________时(填现象),停止加热。
___________ _____________时(填现象),停止加热。
【问题讨论】
(6)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,目的是 ,该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在______________以下。
查看习题详情和答案>>
粗盐提纯的研究。
【有关资料】
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 4.96×10-9 | 4.96×10-9 | 2.34×10-9 | 5.61×10-12 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下:
 【设计除杂过程】
【设计除杂过程】
(1)操作①中需要使用的玻璃仪器有 、 。操作②的名称为 。
(2)混合液A的主要成分是 。(填化学式)
【检验除杂效果】
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是 (填字母)。
A.Na2CO3 B.Na2SO3 C.Na2C2O4
【获取纯净食盐】
(4)对溶液B加热并不断滴加6 mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C,该操作的目的是 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
查看习题详情和答案>>【有关资料】
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 4.96×10-9 | 4.96×10-9 | 2.34×10-9 | 5.61×10-12 |

【设计除杂过程】
(1)操作①中需要使用的玻璃仪器有
(2)混合液A的主要成分是
【检验除杂效果】
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽.向其中一支试管中加入
步骤二:检验Ca2+是否除尽.向另一支试管中加入某溶液,看是否有沉淀生成.效果最好的是
A、Na2CO3 B、Na2SO3 C、Na2C2O4
【获取纯净食盐】
(4)对溶液B加热并不断滴加6mol?L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.该操作的目的是
(5)将溶液C倒入
【问题讨论】
(6)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,目的是
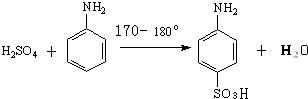
主要试剂及产品的物理常数:
| 名称 | 性状 | 熔点/°C | 沸点/°C | 在水中的溶解度(g/100mL) |
| 苯胺 | 无色油状液体 | -6.1 | 184.4 | 3.6/18℃ |
| 对氨基苯磺酸 | 无色结晶 | 熔点365°C;内盐280~290°C | 0.8/10℃;1.08/20℃;6.67/100℃ | |
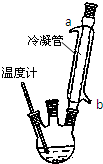
①在一个250mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈 烧瓶放入冷水中冷却,小心地加入18mL浓硫酸.如图所示,在三颈烧瓶的两个瓶口上分别装冷凝管、温度计(水银球浸入反应液中),另一个没有使用的瓶口用塞子塞紧.
②将三颈烧瓶置于______中加热至170~180℃,维持此温度2~2.5h.
③将反应产物冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使对氨基苯磺酸晶体析出.用该烧杯中的少量冷水将烧瓶内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品.
④为提高产品的纯度,将粗产品先______,再______,抽滤,收集产品,晾干.
请回答下列问题:
(1)装置中冷凝管的作用是______,冷却水应从______口(填“a”或“b”)处通入,加入浓硫酸时烧瓶中出现白烟,杯壁上出现白色块状物,写出其反应方程式:______.
(2)步骤②中采用______加热,这种加热方法的优点是______.
(3)步骤③用少量冷水洗涤晶体的好处是______.
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先______,然后______,以防倒吸.
(5)步骤④中将粗产品先______,再______,抽滤,收集产品,晾干,以提高对氨基苯磺酸的纯度.每次抽滤后均应将母液收集起来,再进行适当处理,其目的是______.