摘要:将4 mol/L的Na2CO3溶液250 mL稀释到1000 mL. (1)求稀释后溶液中溶质Na2CO3的质量. (2)求稀释后溶液中Na2CO3的物质的量浓度. (3)将稀释后的1000mL溶液取出400 mL后.求余下溶液中Na+的物质的量浓度.
网址:http://m.1010jiajiao.com/timu3_id_230872[举报]
(1)25℃时,浓度为0.1mol?L-1的6种溶液:①HCl,②CH3OOH,③Ba(OH)2,④Na 2CO3,⑤KCl,
⑥NH4Cl溶液pH由小到大的顺序为 (填写编号).
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh= mol?L-1(保留到小数点后一位).
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈 (填“酸性”,“中性”或“碱性”),请写出溶液中离子浓度间的一个等式: .
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中
c(CH3COO-)+c(CH3COOH)= ,m与n的大小关系是m n(填“>”“=”或“<”).
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3?H2O的电离常数Ka= .
查看习题详情和答案>>
⑥NH4Cl溶液pH由小到大的顺序为
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh=
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中
c(CH3COO-)+c(CH3COOH)=
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3?H2O的电离常数Ka=
在给定条件下,下列画线的物质在化学反应中能被完全消耗的是( )
| A、用浓盐酸与足量二氧化锰共热制取氯气 | B、标准状况下,将1 g铝片投入20 mL 18.4 mol/L的硫酸中 | C、向100 mL 3 mol/L的硝酸中加入5.6 g铁 | D、高温、高压、有催化剂条件下,用1 mol氮气和4 mol氢气合成氨 |
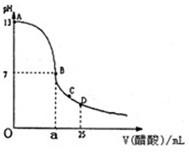 Ⅰ.如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:
Ⅰ.如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:(1)有人认为B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?
否
否
(填“是”或“否”).若不正确,则二者恰好完全反应的点是在AB区间还是在BD区间内?AB
AB
区间.(若正确,此问不答)(2)在AB区间内,c(OH-)>c(H-),则c(OH-)与c(CH3COO-)的大小关系是
D
D
.A.c(OH-)一定大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-) D.c(OH-)可能大于、小于或等于c(CH3COO-)
(3)在D点时,溶液中c(CH3COO-)+c(CH3COOH)
等于
等于
2c(Na+).(填“大于”,“小于”或“等于”)Ⅱ.已知硫酸钡的Ksp为1.0×10-10,碳酸钡的Ksp为2.58×10-9,工业上却可以将硫酸钡转化为碳酸钡,请问至少需要
2.58×10-4
2.58×10-4
mol?L-的碳酸钠溶液浸泡才能实现转化.实现此转化的离子方程式为BaSO4+CO32-≒BaCO3+SO42-
BaSO4+CO32-≒BaCO3+SO42-
.