摘要:实现下列反应需加入氧化剂的是( ) A. NaOH → NaCl B. H2SO4 → H2 C. HCl → Cl2 D. CaCO3 → CO2
网址:http://m.1010jiajiao.com/timu3_id_225858[举报]
有A、B两种互溶的化合物都不溶于水且密度比水小,常温下A为液体,B为固体,A不与NaOH反应,B与NaOH作用生成水和可溶的C,C与盐酸作用可得NaCl和B。分离A和B的混合物,可采用下列方法:
利用这两种化合物在某种试剂中溶解性的差异,可采用萃取的方法加以分离,有机物表现的性质及相关结论―→官能团―→确定结构式。如能使溴的四氯化碳溶液褪色的有机物分子中可能含有![]() ,不能使溴的四氯化碳溶液褪色却能使酸性高锰酸钾溶液褪色的可能是苯的同系物等。
,不能使溴的四氯化碳溶液褪色却能使酸性高锰酸钾溶液褪色的可能是苯的同系物等。
(1)操作的正确顺序是____________(用序号填空),从分液的漏斗的________(填“上”或“下”)层分离出的液体是A;________(用序号填空),从分液漏斗的________(填“上”或“下”)层分离出的液体是B。
可供选择的操作有:①向分液漏斗中加入稀盐酸;②向分液漏斗中加入A和B的混合物;③向分液漏斗中加入氢氧化钠溶液;④充分振荡混合液,静置,分液;⑤将烧杯中的液体重新倒回分液漏斗中。
(2)实验中需要用到的仪器有:铁架台(附有铁夹、铁圈、石棉网)、蒸馏烧瓶、酒精灯、接液管、__________、__________、__________及必要的导管和橡皮塞,首先蒸馏出来的液体是__________。
查看习题详情和答案>>托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础。
(1)其中标示出使用温度的仪器是________________。
(2)下列操作中,容量瓶所不具备的功能有________________ (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的溶液
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)如下图是某些仪器的刻度部分示意图,图中各仪器虚线为所示读数。其中为量筒的是________________ (填编号,下同),读数为________________mL;为滴定管的是________________,读数为________________mL。
(1)其中标示出使用温度的仪器是________________。
(2)下列操作中,容量瓶所不具备的功能有________________ (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的溶液
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)如下图是某些仪器的刻度部分示意图,图中各仪器虚线为所示读数。其中为量筒的是________________ (填编号,下同),读数为________________mL;为滴定管的是________________,读数为________________mL。

(4)下列可能由于错误操作,使所得的数据比正确数据偏小的是_____________。
A.称取4.2 g NaCl固体时,将砝码放在左盘,NaCl固体放在右盘
B.使用容量瓶配制溶液时,定容摇匀后,液面低于刻度线
C.酸式滴定管用蒸馏水洗涤后,直接倒入标准液进行中和滴定
D.用量筒量取一定体积的液体时,俯视液面所得的读数
(5)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、______________、_______________。
(6)量取反应物时,取50 mL 0.50 mol· L-1的盐酸,还需加入的试剂是________________(填序号)。
A.50mL 0.50mol· L-1 NaOH溶液 B.50mL 0.55mol· L-1 NaOH溶液 C.1.0g NaOH固体
(7)已知稀盐酸与稀氢氧化钠溶液反应的中和热ΔH=-57.3 kJ·mol-1,请用离子方程式表示该中和反应的热化学方程式____________________________。
(8)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________________________。
查看习题详情和答案>>
A.称取4.2 g NaCl固体时,将砝码放在左盘,NaCl固体放在右盘
B.使用容量瓶配制溶液时,定容摇匀后,液面低于刻度线
C.酸式滴定管用蒸馏水洗涤后,直接倒入标准液进行中和滴定
D.用量筒量取一定体积的液体时,俯视液面所得的读数
(5)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、______________、_______________。
(6)量取反应物时,取50 mL 0.50 mol· L-1的盐酸,还需加入的试剂是________________(填序号)。
A.50mL 0.50mol· L-1 NaOH溶液 B.50mL 0.55mol· L-1 NaOH溶液 C.1.0g NaOH固体
(7)已知稀盐酸与稀氢氧化钠溶液反应的中和热ΔH=-57.3 kJ·mol-1,请用离子方程式表示该中和反应的热化学方程式____________________________。
(8)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________________________。
(2013?杭州一模)有下列A、B、C 三种氯代烷:
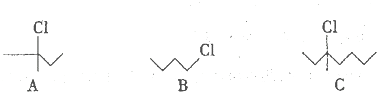
(1)检验这些有机物是否含氯元素有下列方法:①钠熔法②水解法.用水解法进行检验时,所需的化学试剂有
(2)实验室可用相应醇和氯化钠等试剂来制备B,写出该制备反应的化学方程式
(3)有机物C在氢氧化钾的醇溶液中,加热时可发生消去反应,其产物的合理结构有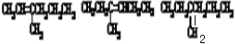
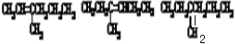 .(写有机物的结构简式)
.(写有机物的结构简式)
查看习题详情和答案>>

(1)检验这些有机物是否含氯元素有下列方法:①钠熔法②水解法.用水解法进行检验时,所需的化学试剂有
NaOH溶液、稀HNO3、AgNO3溶液
NaOH溶液、稀HNO3、AgNO3溶液
(请按这些试剂在使用时加入的顺序写):除上述列举的方法外,还有一种更为简便的方法,这种方法称为铜丝燃烧
铜丝燃烧
法,用该法检验时可观察到的现象灼烧时火焰为绿色
灼烧时火焰为绿色
.(2)实验室可用相应醇和氯化钠等试剂来制备B,写出该制备反应的化学方程式
CH3CH2CH2CH2OH+H2SO4(浓)+NaCl(s)
CH3CH2CH2CH2Cl+NaHSO4+H2O
| △ |
CH3CH2CH2CH2OH+H2SO4(浓)+NaCl(s)
CH3CH2CH2CH2Cl+NaHSO4+H2O
| △ |
(3)有机物C在氢氧化钾的醇溶液中,加热时可发生消去反应,其产物的合理结构有
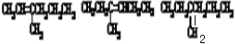
(2012?大兴区一模)亚铁盐在空气中易被氧化,但是形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O 商品名莫尔盐]是一种重要的化学试剂,实验室用废铁片制取硫酸亚铁铵的流程如下方案一所示:
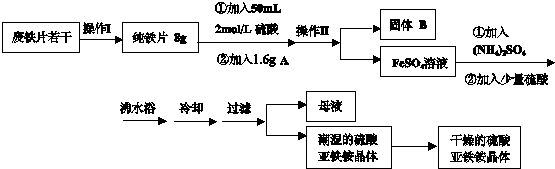
请回答下列问题:
(1)操作Ⅰ主要包括除油、除杂、过滤、烘干、称量等过程,其中除油污需要的最佳试剂
a.H2O b.3mol?L-1 H2SO4 c.热的10%的Na2CO3溶液
(2)若A物质为CuSO4,其加入的目的是
(3)操作Ⅱ的名称是
(4)加入少量硫酸可以调节pH为1~2,其作用是
(5)选用下列提供的试剂,设计实验验证硫酸亚铁铵晶体中含有Fe2+离子,而不含Fe3+.
提供的试剂:稀硫酸,KSCN溶液,新配制的氯水,NaOH溶液.
检验方法:
(6)在此流程中,理论上得到硫酸亚铁铵晶体
相关物质的摩尔质量如下,单位g/mol,(NH4)2SO4:132; FeSO4:152; H2O:18
(7)该流程图中的CuSO4可以发生多种化学反应,如果在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.则生成CuCl的离子方程式是
查看习题详情和答案>>

请回答下列问题:
(1)操作Ⅰ主要包括除油、除杂、过滤、烘干、称量等过程,其中除油污需要的最佳试剂
c
c
(填序号) a.H2O b.3mol?L-1 H2SO4 c.热的10%的Na2CO3溶液
(2)若A物质为CuSO4,其加入的目的是
形成微小原电池,加快铁与硫酸反应速率
形成微小原电池,加快铁与硫酸反应速率
,则固体B的成分为铁和铜
铁和铜
.(3)操作Ⅱ的名称是
过滤
过滤
,所用主要玻璃仪器有:烧杯、玻璃棒、漏斗
玻璃棒、漏斗
.(4)加入少量硫酸可以调节pH为1~2,其作用是
Fe2++2H2O?Fe (OH)2+2H+ NH4++H2O?NH3?H2O+H+加入硫酸保持酸性,抑制Fe2+、NH4+离子的水解,得到更多的产品
Fe2++2H2O?Fe (OH)2+2H+ NH4++H2O?NH3?H2O+H+加入硫酸保持酸性,抑制Fe2+、NH4+离子的水解,得到更多的产品
(结合化学用语和简要语言说明).(5)选用下列提供的试剂,设计实验验证硫酸亚铁铵晶体中含有Fe2+离子,而不含Fe3+.
提供的试剂:稀硫酸,KSCN溶液,新配制的氯水,NaOH溶液.
检验方法:
取硫酸亚铁铵晶体少量溶解于试管中形成溶液,加入KSCN溶液无现象,加入新配制的氯水溶液呈血红色证明含有亚铁离子,不含铁离子
取硫酸亚铁铵晶体少量溶解于试管中形成溶液,加入KSCN溶液无现象,加入新配制的氯水溶液呈血红色证明含有亚铁离子,不含铁离子
.(6)在此流程中,理论上得到硫酸亚铁铵晶体
39.2
39.2
g(精确到小数点后两位).相关物质的摩尔质量如下,单位g/mol,(NH4)2SO4:132; FeSO4:152; H2O:18
(7)该流程图中的CuSO4可以发生多种化学反应,如果在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.则生成CuCl的离子方程式是
2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+
| ||
2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+
.
| ||