摘要:16配平下列化学方程式 ⑴ Cu + HNO3浓 -- Cu(NO3 )2 + NO2↑ + H2O ⑵ MnO4-+ Fe2++ H+-- Mn 2++ Fe 3++ H2O17.下表标出的是元素周期表的一部分元素.回答下列问题 (1)表中用字母标出的14种元素中.化学性质最不活泼的是 .金属性最强的是 .非金属性最强的是 .常温下单质为液态的非金属元素是 . (2)C.G.F的气态氢化物中以 最不稳定 (3)I.H号元素最高价氧化物对应水化物的碱性强弱顺序是 (4)以上原子形成的离子中.与NH4+具有相同电子数和质子数的是 (5)写出D元素形成的两种同素异形体的名称 和 (6)用电子式表示K与F形成化合物的形成过程
网址:http://m.1010jiajiao.com/timu3_id_224749[举报]
 (2011?深圳一模)氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.
(2011?深圳一模)氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是
氟化氢是共价化合物,纯液态时不电离,因而不导电
氟化氢是共价化合物,纯液态时不电离,因而不导电
;但电解液态KHF2时,两极分别得到F2和H2,写出阳极上HF2-放电产生气体的电极反应式HF2--2e-=F2↑+H+
HF2--2e-=F2↑+H+
.(2)利用化学反应也能制取氟.请配平下列化学方程式:
2
2
K2MnF6+4
4
SbF5--4
4
KSbF6+2
2
MnF3+1
1
F2↑;其中还原产物是MnF3
MnF3
.(3)某温度下测得浓度均为0.10mol?L-1的KF和HF混合溶液的pH=4,近似计算HF的电离平衡常数K a(写出计算过程).
(4)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量?随pH的分布曲线如图示.用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式:
AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-
AlF2++3OH-=Al(OH)3↓+2F-、AlF3+3OH-=Al(OH)3↓+3F-
.配平下列化学方程式
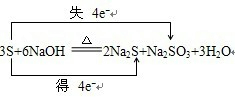
 .
.
查看习题详情和答案>>
3
3
S+6
6
NaOH
| ||
2
2
Na2S+1
1
Na2SO3+3
3
H2O指出被氧化的元素是S
S
,被还原的元素是S
S
,氧化产物Na2SO3
Na2SO3
,还原产物Na2S
Na2S
,氧化剂与还原剂的质量比是2:1
2:1
并用双线桥表示该反应转移的电子方向和数目

(2013?闵行区一模)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
a.煤的形成 b.原电池工作
c.简单机械织布 d.我国古代烧制陶器
(2)水是人体的重要组成部分,是人体中含量最多的一种物质.“四种基本反应类型与氧化还原反应的关系”可用下图表示.

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2.配平下列化学方程式并标明电子转移的方向和数目:
(4)已知:还原性HSO3->I-,若加入的NaHSO3过量,还可能与上述生成物中的
查看习题详情和答案>>
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
c
c
(选填编号).a.煤的形成 b.原电池工作
c.简单机械织布 d.我国古代烧制陶器
(2)水是人体的重要组成部分,是人体中含量最多的一种物质.“四种基本反应类型与氧化还原反应的关系”可用下图表示.

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
2F2+2H2O=4HF+O2或2Na+2H2O=2NaOH+H2↑或C+H2O
CO+H2
| ||
2F2+2H2O=4HF+O2或2Na+2H2O=2NaOH+H2↑或C+H2O
CO+H2
.
| ||
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2.配平下列化学方程式并标明电子转移的方向和数目:
4
4
NaIO3+10
10
NaHSO3→2
2
I2+7
7
Na2SO4+3
3
H2SO4+2
2
H2O(4)已知:还原性HSO3->I-,若加入的NaHSO3过量,还可能与上述生成物中的
I2
I2
反应,离子方程式为H2O+I2+HSO3-=2I-+SO42-+3H+
H2O+I2+HSO3-=2I-+SO42-+3H+
.Cu20是不溶于水的碱性物质,能溶于酸发生歧化反应,生成Cu和Cu2+.测Cu20在矿石中含量的方法为:将矿石溶于足量的Fe2(S04)和H2S04的混合溶液中,然后用KMn04测定.
(1)完成并配平下列化学方程式:□Cu2O+□Fe2(SO4)3+□H2SO4--□CuSO4+□FeSO4+□
(2)滴入KMnO4时发生反应的离子方程式为
(3)若每次测定中称取5.00g矿样,滴定时消耗O.10mol/LKMn04溶液100mL.通过计算确定矿样中Cu20的质量分数为
查看习题详情和答案>>
(1)完成并配平下列化学方程式:□Cu2O+□Fe2(SO4)3+□H2SO4--□CuSO4+□FeSO4+□
H2O
H2O
. (2)滴入KMnO4时发生反应的离子方程式为
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
.(3)若每次测定中称取5.00g矿样,滴定时消耗O.10mol/LKMn04溶液100mL.通过计算确定矿样中Cu20的质量分数为
72.0%
72.0%
.