网址:http://m.1010jiajiao.com/timu3_id_223850[举报]
小刚、小军、小红对一久置的
NaOH白色粉末的成分进行探究并测定其成分的含量.(一)成分的确定
三位同学都作出以下的猜想:
①可能是NaOH;②可能是Na2CO3;③可能是NaOH与Na2CO3的混合物.
做出②③猜想的依据是________(用化学方程式表示)
为了验证①②③猜想,他们分别做了下面的实验.
(1)小刚取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中一定含有________,肯定猜想________(填序号)是错误的.
(2)小军又取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色.由此小军结合小刚的实验,认为猜想③是正确的.小红却认为小军的所得结论不确切,因为________.
(3)为探究白色粉末是否含有NaOH,小红设计了如下实验方案:
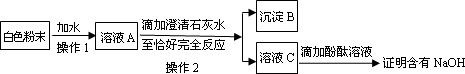
①沉淀
B的化学式为________.②在操作
1中要用到玻璃棒,其作用是________;在操作2中,除要用到铁架台(带铁圈)、烧杯、滤纸、玻璃棒外,还需补充的玻璃仪器是________.③小刚认为小红的这个方案也有问题,理由是
________.但只要稍加改进,就可以证明粉末中还含有NaOH,则小刚改进的方法是________.小刚对小红的实验作了正确的改进后进行了实验,实验现象和小红的一致,由此确定猜想③是正确的.(二)各成分含量的测定
三位同学利用电子天平共同作了以下测定实验.

实验数据记录如下:

(1)写出锥形瓶中发生反应化学方程式:________;________.
(2)试通过分析表中数据计算出混合物中试样中各成份的质量分数.
(三)实验反思:
有同学提出按上述实验所测得试样中
(11分) 硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。研究小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
(1)他们提出如下猜想:猜想①:与BaCl2溶液反应有沉淀生成;猜想②:溶液呈中性,且不与酸反应;猜想③:无还原性,不能被氧化剂氧化。
他们提出上述猜想的依据是__________________________________________________。
(2)对上述猜想②、③,他们设计实验方案,并进行实验。请在答题卡上按下表格式完成相关的实验操作步骤、预期现象。请限选实验仪器与试剂:试管、玻璃棒、滴管、pH试纸:3 mol?L-1H2SO4、新制氯水、1 mol?L-1 BaCl2 溶液、Na2S2O3溶液、蒸馏水。
| 实验操作 | 实验现象或 预期实验现象 | 现象解释 (用离子方程式表示) | 结论 |
猜想② | 操作一: | 溶液pH=8 |
| Na2S2O3溶液呈中性,能与酸反应,具有还原性,与Na2SO4的化学性质不相似。 |
操作二: |
| S2O32―+2H+=S↓+SO2↑+H2O | ||
猜想③ | 操作三: |
|
|
(3)小组同学为确证经操作三后Na2S2O3被氧化,提出如下实验方案________________________________________________________________________________________________________________________________________________________________________________。
查看习题详情和答案>>某化学兴趣小组有一次活动的内容是:对一包干燥的红色粉末组成进行探究.请你参与并回答有关问题.
教师提醒:它由Cu、Fe2O3、Fe(OH)3三种固体中的一种或两种组成.
提出猜想:红色粉末可能的组成有:
①只有Cu ②只有Fe2O3
③只有Fe(OH)3④是Fe2O3、Fe(OH)3的混合物
⑤是Cu、Fe2O3的混合物 ⑥是Cu、Fe(OH)3的混合物
资料获悉:(1)2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
(2)白色无水CuSO4遇水变蓝
(3)Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
探究思路:利用物质的性质不同设计实验加以甄别,先分别探究其中是否含有Fe(OH)3、Cu等,逐步缩小范围,然后再选择适当的试剂和方法通过实验探究其组成.
(装置内空气中的水蒸气、CO2忽略不计)
实验探究:

(1)甲同学取适量红色粉末装入试管中,按图1进行实验.结果无水CuSO4没有变蓝,从而排除猜想中的______.(填猜想中的序号)
(2)在甲同学实验结论的基础上,乙同学另取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解,溶液变色.乙同学认为可以排除猜想中的①和⑤,而丙同学认为只能排除猜想①,你认为______的观点正确(填“乙”“丙”).
(3)丁同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按图2在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:
| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ 组 | 洗气瓶和所盛溶液 的总质量为180.0g | 洗气瓶和瓶中物质 的总质量为183.1g |
(1)在装置A中先通CO气体的作用是______.
(2)应该选择______组的实验数据计算来确定红色粉末的组成.最终计算结果表明:该红色粉末的组成是猜想中的第______组(填序号).
(3)写出A装置中发生反应的化学方程式______;实验中观察到A装置中的现象为______.
(4)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?______(填“需要”或“不需要”),理由是______.
反思评价:戊同学指出:从环保角度,图2装置有严重不足之处.你认为应该如何改进?______.
拓展延伸:有同学提出丁同学上述实验中的CO还可以用H2代替,并将图28-2中B装置换成盛有碱石灰(生石灰和氢氧化钠固体混合物)的干燥管,来确定该红色粉末的组成,你认为是否可行?______(填“可行”或“不可行”). 查看习题详情和答案>>
常见的治疗缺铁性贫血的方法是服用补铁药物,市场上一种常见的补铁药物的商品名称是:速力菲,正式名称是:琥珀酸亚铁薄膜片,为棕黄色薄膜衣片,除去薄膜衣后显暗黄色,药片中Fe2+的含量约为34.0%~36.0%.该药片在水和乙醇中的溶解度不大.某学校化学实验小组为了检测“速力菲”药片中Fe2+的存在,设计了如下几组理论实验设计方案:
Ⅰ.甲组方案:
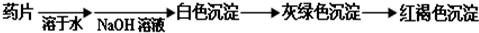
(提示:白色的Fe(OH)2在空气中会迅速变成灰绿色,最后变成红褐色)
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果.分析甲组实验失败的可能原因:______.
Ⅱ.乙组同学在参考书上查得如下资料:
①人体胃液中有大量盐酸,能溶解多种物质.
②H2O2不稳定,光照、加热和微量杂质会促使其分解;H2O2中氧元素为-1价,它既有氧化性又有还原性.
他们认真思考了甲组实验失败的原因,模拟药服用后在人体中溶解的变化过程,重新设计并完成下列实验:
乙组方案:
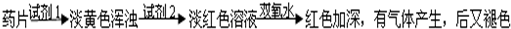
(1)试剂1为:______,试剂2为:______;
(2)加入试剂2后,溶液显淡红色的原因是:______;
(3)加双氧水后,红色加深的原因是:______.根据氧化还原反应中化合价变化情况,试写出在酸性条件下Fe2+与双氧水反应的离子方程式:______.
Ⅲ.丙组同学对乙组实验中最后红色褪去的现象产生了浓厚的兴趣,欲探究其褪色的原因.根据粒子的组成,他们认为有两种可能原因:①[Fe(SCN)]2+中的三价铁被还原为亚铁;②______.
请你对其中一种可能进行实验验证:
实验方案(用文字叙述):______.
根据预期现象判断结论:______.
查看习题详情和答案>>
Ⅰ.甲组方案:
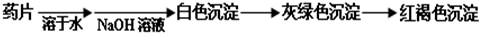
(提示:白色的Fe(OH)2在空气中会迅速变成灰绿色,最后变成红褐色)
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果.分析甲组实验失败的可能原因:______.
Ⅱ.乙组同学在参考书上查得如下资料:
①人体胃液中有大量盐酸,能溶解多种物质.
②H2O2不稳定,光照、加热和微量杂质会促使其分解;H2O2中氧元素为-1价,它既有氧化性又有还原性.
他们认真思考了甲组实验失败的原因,模拟药服用后在人体中溶解的变化过程,重新设计并完成下列实验:
乙组方案:
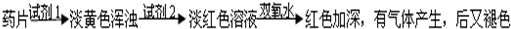
(1)试剂1为:______,试剂2为:______;
(2)加入试剂2后,溶液显淡红色的原因是:______;
(3)加双氧水后,红色加深的原因是:______.根据氧化还原反应中化合价变化情况,试写出在酸性条件下Fe2+与双氧水反应的离子方程式:______.
Ⅲ.丙组同学对乙组实验中最后红色褪去的现象产生了浓厚的兴趣,欲探究其褪色的原因.根据粒子的组成,他们认为有两种可能原因:①[Fe(SCN)]2+中的三价铁被还原为亚铁;②______.
请你对其中一种可能进行实验验证:
实验方案(用文字叙述):______.
根据预期现象判断结论:______.