网址:http://m.1010jiajiao.com/timu3_id_223791[举报]
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2Mg0.B203.H20、 Si02及少量Fe304、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:
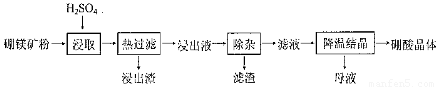
已知:H3BO3在200C、400C、600C、1000C时的溶解度依次为5.0 g、8.7 g、14.8 g、 40. 2 g。Fe3 +、Al3 +、Fe2 +和Mg2 +以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、 5.2、9.7和 12.4。
(1)由于矿粉中含CaC03,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是: ??????????????????????????????????????????????????????????????????????????????????? 。
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是_______。H2O2的作用是____________________________________________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________________。
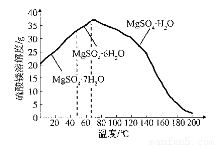
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶 液的沸点随压强增大而升高。为了从“母液”中充分回收MgS04·H20,应采取的 措施是将“母液”蒸发浓缩,____________
(5)硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4]-(aq)+H+(aq)?? K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq)?? K=5.7×10-10(298K)
计算25℃时0.7mol·L-1 硼酸溶液中H+的浓度。(写出计算过程)
(6)已知298K时:
化学式 | 碳酸 | 醋酸 |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是??????????????? 。
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸中能观察到有气泡产生
C.等浓度的碳酸和硼酸溶液比较,pH:前者>后者
D.等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者
查看习题详情和答案>>
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO•B2O3•H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:

已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、5.2、9.7和12.4。
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器溢出,故应分批加入稀硫酸。该反应的化学方程式为 。
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO42-,还含有Fe3 +、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是 。H2O2的作用是 (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是 。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4•H2O,应采取的措施是将“母液”蒸发浓缩, 。

查看习题详情和答案>>
卤族元素(9F、17Cl、35Br、53I、85At)是重要的非金属元素,它们的单质及其化合物不仅在无机化学中有极其广泛的应用,而且在有机化学中也表现不俗。请回答下列有关问题:
(1)指出氯元素在元素周期表中的位置 ;
(2)下列关于卤族元素的叙述不正确的是 (填字母);
A.卤素单质的颜色随原子序数的递增,由浅到深
B.卤化氢的沸点随原子序数的递增,由低到高
C.新制的氯水滴加到碘化钾溶液中,再滴加淀粉溶液呈蓝色,说明氯元素非金属性比碘强
D.氯化铁溶液中混有少量氯化亚铁,可滴加适量溴水除去
(3)利用你所学的有机反应,用化学方程式表示在有机化合物分子中引入卤素原子的方法
① 引入一个卤素原子,且属于取代反应: ;
② 引入两个卤素原子,且属于加成反应: ;
③ 引入四个卤素原子,且属于加成反应: 。
(4)海水中含有丰富的卤素,其中提取溴的一种工艺方法是在预先经过酸化的浓缩海水中通入氯气使溴离子转化成单质溴,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化成氢溴酸以达到富集的目的。然后再用氯气将其氧化得到产品溴。
① 写出第二步转化的离子方程式: ;
② 用此法从海水中提取1mol溴单质,总共需要氯气 mol。
(5) 某校探究小组将少量粉末状硫磺撒到新制氯水中,充分振荡,硫磺粉消失,并检测到有两种强酸生成。写出该反应的化学方程式: 。
查看习题详情和答案>>(12分)在给定实验条件下,一元弱酸HA在苯(B)和水(W)的分配系数KD=[HA]B/[HA]W=1.00。已知水相和苯相中HA的分析浓度分别为3.05×10-3 和3.96×10-3 mol?L-1。在水中,HA按HA⇌H++A-解离,Ka=1.00×10-4;在苯中,HA发生二聚:2HA⇌(HA)2。
6-1 计算水相中各物种的浓度及pH。
6-2 计算化合物HA在苯相中的二聚平衡常数。
6-3 已知HA中有苯环,1.00gHA含3.85×1021个分子,给出HA的化学名称。
6-4 解释HA在苯中发生二聚的原因,画出二聚体的结构。
查看习题详情和答案>>(1)钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取.该反应为:Na(l)+KCl(l)
 NaCl(l)+K(g) ΔH>0,该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见下表.
NaCl(l)+K(g) ΔH>0,该反应的平衡常数可表示为:K=c(K),各物质的沸点与压强的关系见下表. 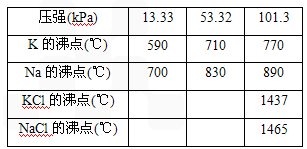
②常压下,当反应温度升至900℃时,该反应的平衡常数可表示为:K=________.
(2)实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-
 I3- 上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).
I3- 上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态). 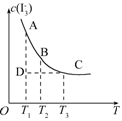
②在T1、D状态时,v正________v逆(填“>”“<”或“=”).