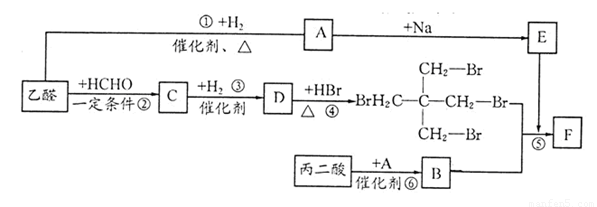
摘要:19..C26H40O2
网址:http://m.1010jiajiao.com/timu3_id_223062[举报]
下列说法正确的是( )
| A、在100℃、101kPa条件下,液态水的气化热为40.69kJ?mol-1,则H2O(g)?H2O(l) 的△H=+40.69 kJ?mol-1 | ||||||||||
| B、已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 | ||||||||||
| C、常温下,在0.10mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,能使NH3?H2O的电离度降低,溶液的pH减小 | ||||||||||
D、已知:
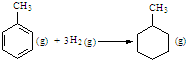 的△H为-384 kJ?mol-1 的△H为-384 kJ?mol-1 |
下列说法正确的是:( )
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69
kJ·mol-1,则H2O(g) H2O(l) 的ΔH ="+" 40.69 kJ·mol-1
H2O(l) 的ΔH ="+" 40.69 kJ·mol-1
B.已知MgCO3的Ksp =" 6.82" × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-)=" 6.82" × 10-6
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
D.已知:
|
共价键 |
C-C |
C=C |
C-H |
H-H |
|
键能/ kJ·mol-1 |
348 |
610 |
413 |
436 |
则可以计算出反应 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1
查看习题详情和答案>>
下列说法正确的是:( )
A.反应A(g) 2B(g);△H,若正反应的活化能为Ea kJ
mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
2B(g);△H,若正反应的活化能为Ea kJ
mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
B.已知25℃时,有关弱酸的电离平衡常数:HCN Ka=4.9×10-10 ; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11。则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3
C.已知:
|
共价键 |
C-C |
C=C |
C-H |
H-H |
|
键能/ kJ·mol-1 |
348 |
610 |
413 |
436 |
则反应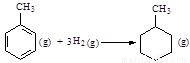 的焓变为ΔH
= -384
kJ·mol-1
的焓变为ΔH
= -384
kJ·mol-1
D、一定浓度的NaOH溶液,温度升高PH值不变
查看习题详情和答案>>
下列说法正确的是:
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH =" 40.69" kJ·mol-1 H2O(l) 的ΔH =" 40.69" kJ·mol-1 |
| B.已知MgCO3的Ksp =" 6.82" × 10-6,则所有含有固体MgCO3的溶液中,都有 c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-) =" 6.82" × 10-6 |
C.已知: 则可以计算出反应  的ΔH为-384 kJ·mol-1 的ΔH为-384 kJ·mol-1 |
| D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小 |