摘要:7.炎热的夏天.小林打开冰箱.从4℃的储藏室里拿出一杯底部有少量蔗糖晶体的溶液a.在室温下放置一段时间后.发现晶体消失了.得到溶液b.判断下列说法正 确的是 A.4℃时.a溶液一定是饱和溶液 B.室温下.b溶液-定是饱和溶液 C.蔗糖晶体的溶解度随温度的升高而降低 D.a溶液的溶质质量分数大于b溶液的溶质质量分数
网址:http://m.1010jiajiao.com/timu3_id_222574[举报]
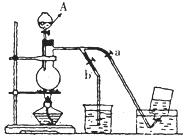 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)(1)仪器A的名称是
分液漏斗
分液漏斗
;水槽中应盛放的是饱和食盐水
饱和食盐水
;烧杯中盛放的是氢氧化钠溶液
氢氧化钠溶液
;烧瓶中反应的化学方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
(2)在收集氯气时,应
关闭b,打开a
关闭b,打开a
.当氯气收集完毕时应关闭a,打开b
关闭a,打开b
.(填如何控制a、b)【化学--选修2:化学与技术】自来水生产的流程示意图见下:

(1)混凝剂除去悬浮物质的过程
①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4?7H2O是常用的混凝剂,它在水中最终生成
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加
(3)氯气消毒,是因为它与水反应生成了HClO,次氯酸的强氧化性能杀死水中的病菌(不能直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).
Cl2+H2O?HCl+HClO K=4.5×10-4
使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:
①臭氧 ②NH3(液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子.用离子交换树脂软化硬水时,先后把水通过分别装有
(5)测定水中的溶解氧:量取40mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应.打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成.用0.010mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液.已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+.上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2 MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-
则水中的溶解氧量为
查看习题详情和答案>>

(1)混凝剂除去悬浮物质的过程
③
③
(填写序号)①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4?7H2O是常用的混凝剂,它在水中最终生成
Fe(OH)3
Fe(OH)3
沉淀.(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加
石灰
石灰
后加纯碱
纯碱
,原因是过量的钙离子可通过纯碱使之沉淀下来
过量的钙离子可通过纯碱使之沉淀下来
.(3)氯气消毒,是因为它与水反应生成了HClO,次氯酸的强氧化性能杀死水中的病菌(不能直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).
Cl2+H2O?HCl+HClO K=4.5×10-4
使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:
由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO
由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO
.下列物质中,①③
①③
可以作为氯气的代用品(填写序号).①臭氧 ②NH3(液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子.用离子交换树脂软化硬水时,先后把水通过分别装有
阳
阳
离子交换树脂和阴
阴
离子交换树脂的离子交换柱(填“阴”或“阳”,阳离子交换树脂为HR型,阴离子交换树脂为R′OH型).(5)测定水中的溶解氧:量取40mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应.打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成.用0.010mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液.已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+.上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2 MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62-
则水中的溶解氧量为
12.0
12.0
mg?L-1.