摘要:写出电子式:NaCl H2O Cl2 用电子式表示Na2O形成过程
网址:http://m.1010jiajiao.com/timu3_id_216503[举报]
(1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO═Cu+H2O所属的区域是
 .
.
②“四种基本反应类型与氧化还原反应的关系”也可用B图表达.其中Ⅰ为化合反应,则Ⅱ为

(2)已知反应:①SO3+H2O═H2SO4
②Cl2+H2O═HCl+HClO
③2F2+2H2O═4HF+O2
④2Na+2H2O═2NaOH+H2↑
⑤2Na2O2+2H2O═4NaOH+O2↑
⑥SiO2+2NaOH═Na2SiO3+H2O
上述反应中不属于氧化还原反应的有
(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
Mn元素的化合价由
(4)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2.
查看习题详情和答案>>


②“四种基本反应类型与氧化还原反应的关系”也可用B图表达.其中Ⅰ为化合反应,则Ⅱ为
分解
分解
反应.写出有水生成的符合反应类型Ⅲ的一个化学方程式:NaOH+HCl═NaCl+H2O
NaOH+HCl═NaCl+H2O
.写出有水参加的符合反应类型Ⅳ的一个化学方程式:2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
,其中水为氧化
氧化
剂.
(2)已知反应:①SO3+H2O═H2SO4
②Cl2+H2O═HCl+HClO
③2F2+2H2O═4HF+O2
④2Na+2H2O═2NaOH+H2↑
⑤2Na2O2+2H2O═4NaOH+O2↑
⑥SiO2+2NaOH═Na2SiO3+H2O
上述反应中不属于氧化还原反应的有
①⑥
①⑥
(填序号,下同);H2O被氧化的是③
③
,H2O被还原的是④
④
,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是②⑤
②⑤
.(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
Mn元素的化合价由
+7
+7
价变为+2
+2
价,被还原
还原
;Cl
Cl
元素的原子失去电子,被氧化
氧化
;若参加反应的HCl是73g,则被氧化的HCl是45.625
45.625
g.(4)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
D
D
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2.
X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大.已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8.
(1)请写出元素Y的原子结构示意图:
 ;其中元素W在周期表中的位置:
;其中元素W在周期表中的位置:
(2)用电子式表示X与W形成化合物的过程:
 .
.
(3)X、Y、Z、W的原子半径由大到小的顺序为:
(4)请写出W的单质与X的最高价氧化物对应水化物反应的化学方程式:
(5)元素X与元素Y相比,金属性较强的是
查看习题详情和答案>>
(1)请写出元素Y的原子结构示意图:


第三周期、ⅢA族
第三周期、ⅢA族
.(2)用电子式表示X与W形成化合物的过程:


(3)X、Y、Z、W的原子半径由大到小的顺序为:
Na>Al>Cl>N
Na>Al>Cl>N
.(用元素符号表示)(4)请写出W的单质与X的最高价氧化物对应水化物反应的化学方程式:
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.(5)元素X与元素Y相比,金属性较强的是
Na
Na
(用元素符号表示),请举一例实验事实证明这一结论:钠与水反应比铝要剧烈
钠与水反应比铝要剧烈
.如图中,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.

(1)上述装置中有一处错误,请指出是
(2)通过B是为了除去
(3)写出D、F中发生反应的化学方程式
(4)如果A中产生氯气3.36L(标准状况),请计算:
①写出A中方程式,并用双线桥法分析A中的电子转移情况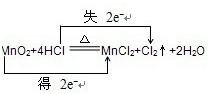
 .
.
②消耗MnO2的物质的量
③被氧化的HCl的物质的量
查看习题详情和答案>>

(1)上述装置中有一处错误,请指出是
B
B
处(用字母表示).(2)通过B是为了除去
HCl
HCl
,在B中应加入饱和食盐水
饱和食盐水
;通过C是为了除去水蒸气
水蒸气
.(3)写出D、F中发生反应的化学方程式
2Fe+3Cl2
2FeCl3
| ||
2Fe+3Cl2
2FeCl3
、
| ||
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.(4)如果A中产生氯气3.36L(标准状况),请计算:
①写出A中方程式,并用双线桥法分析A中的电子转移情况


②消耗MnO2的物质的量
0.15mol
0.15mol
.③被氧化的HCl的物质的量
0.3mol
0.3mol
.(2013?江西二模)以食盐为原料进行生产并综合利用的某些过程如图所示.
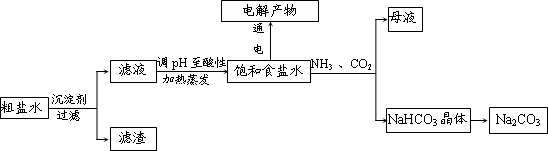
(1)除去粗盐中的Ca2+、Mg2+和SO4-2离子,加入下列沉淀剂的顺序是(填序号)
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是
(3)电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是
(5)某探究活动小组将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出).
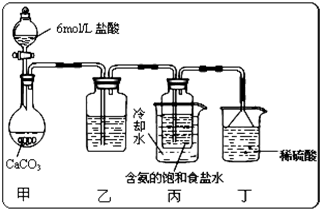
试回答下列有关问题:
①乙装置中的试剂是
②丁装置中稀硫酸的作用是
③实验结束后,分离出NaHCO3 晶体的操作是
(6)纯碱在生产生活中有广泛的应用.
①纯碱可用于除灶台油污.其原因是(结合离子方程式表述)
②工业上,可以用纯碱代替烧碱生产某些化工产品.如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是
查看习题详情和答案>>

(1)除去粗盐中的Ca2+、Mg2+和SO4-2离子,加入下列沉淀剂的顺序是(填序号)
cab或cba或bca
cab或cba或bca
.a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是
CO32-和OH-
CO32-和OH-
.(3)电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:
NaCl+H2O
NaClO+H2↑
| ||
NaCl+H2O
NaClO+H2↑
.
| ||
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是
NH3
NH3
.(5)某探究活动小组将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出).

试回答下列有关问题:
①乙装置中的试剂是
饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
;②丁装置中稀硫酸的作用是
吸收未反应的氨气
吸收未反应的氨气
;③实验结束后,分离出NaHCO3 晶体的操作是
过滤
过滤
(填分离操作的名称).(6)纯碱在生产生活中有广泛的应用.
①纯碱可用于除灶台油污.其原因是(结合离子方程式表述)
碳酸根离子水解显碱性,CO32-+H2O?HCO3-+OH-,油污在碱性条件下水解而被除去
碳酸根离子水解显碱性,CO32-+H2O?HCO3-+OH-,油污在碱性条件下水解而被除去
.②工业上,可以用纯碱代替烧碱生产某些化工产品.如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是
2CO32-+Cl2+H2O=2HCO3-+Cl-+ClO-
2CO32-+Cl2+H2O=2HCO3-+Cl-+ClO-
.(已知碳酸的酸性强于次氯酸).(2011?烟台模拟)食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为
②加盐酸的目的是(用离子方程式表示)
(2)某化学小组拟采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性.

①写出甲中反应的化学方程式
②为完成上述实验,正确的连接顺序为A连
③乙装置中X试剂可以是
④测定Cu的相对原子质量.
将ω g CuO置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量.

请回答:
你认为方案
.
..
查看习题详情和答案>>
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为
BaCl2、NaOH、Na2CO3
BaCl2、NaOH、Na2CO3
(只填化学式).②加盐酸的目的是(用离子方程式表示)
H++OH-═H2O,CO32-+2H+═H2O+CO2↑
H++OH-═H2O,CO32-+2H+═H2O+CO2↑
.(2)某化学小组拟采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性.

①写出甲中反应的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
②为完成上述实验,正确的连接顺序为A连
E
E
,B连C
C
(填接口字母).③乙装置中X试剂可以是
淀粉KI溶液
淀粉KI溶液
,丙装置中Y试剂的作用是吸收氢气中的水
吸收氢气中的水
.④测定Cu的相对原子质量.
将ω g CuO置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量.

请回答:
你认为方案
二
二
较佳,另一个方案得到的Cu的相对原子质量会偏低
偏低
填“偏低”、“偏高”).按较佳方案计算,得到Cu的相对原子质量是| 16(d+w-c) |
| c-d |
| 16(d+w-c) |
| c-d |